-
(1)已知: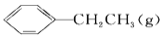

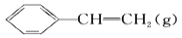 +H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的
+H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的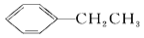 浓度变化曲线未表示出):
浓度变化曲线未表示出):
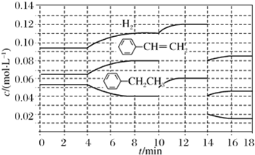
①第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________(填“<”、“>”或“=”)T(8);第10 min时反应改变的条件是_______________________________。
②比较产物苯乙烯在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小___________。
(2)页岩气的主要成分为CH4,请回答下列问题:
①已知甲烷的燃烧热为890 kJ/mol;N2与O2反应生成NO的过程如下:
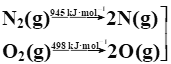
 2NO(g)
2NO(g)
则CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(l) ΔH=______kJ/mol。
②页岩气可用于生产合成气(CO和H2) 其反应的热化学方程式为CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=206.2 kJ/mol。对于气相反应,用各组分的平衡压强(p)表示平衡常教(记作Kp),则生产合成气的Kp=_____(写出计算的表达式),你认为可同时提高化学反应速率和CH4转化率的措施是 ______(答出一条即可)。
③在某一给定进料比的情况下,温度、压强对平衡时H2物质的量分数的影响如图所示。
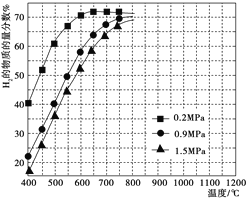
由图可知,在相同温度下,CH4的转化率随压强的增大而________(填“增大”“减小”或“不变”)。若要达到H2的物质的量分数>65%,以下条件中最合适的是_________(填序号)。
a.600℃,0.2 MPa b.600℃,0.9 MPa
c.700℃,0.9 MPa d.800℃,1.5 MPa
-
下列能确认化学平衡发生了移动的是( )
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
-
一定条件下,向密闭容器中充入1 mol N2和3mol H2 ,发生反应:N2(g) + 3H2(g) 2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
A.保持温度和压强不变,充入1 mol NH3(g)
B.保持温度和体积不变,充入1 mol Ar(g)
C.保持温度和压强不变,充入1 mol N2(g) 和3mol H2 (g)
D.保持温度和压强不变,充入1 mol Ar(g)
-
一定条件下,向密闭容器中充入1mol N2和3mol H2,发生反应:N2(g)+3H2(g) 2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是( )
2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是( )
A.保持温度和压强不变,充入1mol NH3(g)
B.保持温度和体积不变,充入1mol Ar(g)
C.保持温度和压强不变,充入1mol N2(g)和3mol H2(g)
D.保持温度和压强不变,充入1mol Ar(g)
-
光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
-
已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
| 温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
| 20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
| 30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
-
在密闭容器中进行如下反应:I2(g)+H2(g) 2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol•L-1 、0.3mol•L-1、0.2mol•L-1,一定条件下当反应达到平衡时,各物质的浓度有可能是
2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol•L-1 、0.3mol•L-1、0.2mol•L-1,一定条件下当反应达到平衡时,各物质的浓度有可能是
A.H2为0.15mol•L-1 B.HI为0.35mol•L-1
C.I2为0.2mol•L-1 D.HI为0.4mol•L-1
-
一定条件下,向一带活塞的密闭容器中充入1 mol N2和3 mol H2,发生下列反应:N2(g)+3H2(g) 2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是
2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是
A. 保持温度和容器压强不变,充入1 mol NH3(g)
B. 保持温度和容器体积不变,充入1 mol NH3(g)
C. 保持温度和容器压强不变,充入1 mol N2(g)
D. 保持温度和容器体积不变,充入1 mol H2(g)
-
向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。则下列说法不正确的是
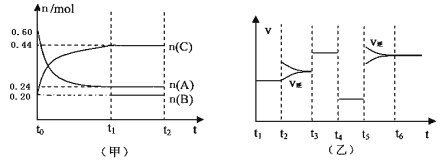
A.若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L·s)
B.B既不是反应物,也不是生成物,可能是反应的催化剂
C.若t2—t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小。
D.该反应为放热反应,t5—t6阶段是升高反应体系的温度
-
400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。
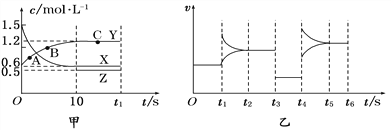
(1)反应从开始至平衡时v(X)=________________;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________;400 ℃时该反应的平衡常数为________。
(3)t4 s时改变的条件是________,若该反应具有自发性,则此时平衡向________________(填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g) 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g) Z(g) ΔH3
Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________。
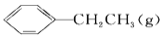
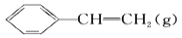 +H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的
+H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的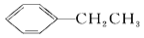 浓度变化曲线未表示出):
浓度变化曲线未表示出):
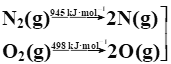
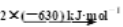 2NO(g)
2NO(g)


