-
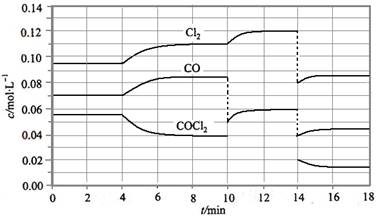
光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):
(1) 计算反应在第8 min 时的平衡常数K = ________;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ________mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6)________v(12~13) (填“<”、“>”或“=”),原因是________。
-
T℃时,在密闭容器中进行的反应:COCl2(g)⇌CO(g)+Cl2(g)△H=108kJ·mol-1,在4min、10min、14min时均只改变影响平衡的一个条件,各物质的浓度变化如图所示:
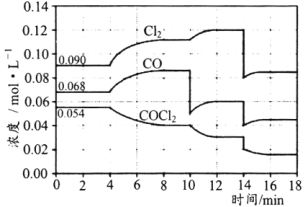
下列说法正确的是( )
A.4min时改变的条件是:降低体系的温度
B.10min时改变的条件是:向体系中再充入Cl2
C.14min时改变的条件是:增大容器的体积
D.若T℃时,起始向2L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20mol,则达到平衡前,v正>v逆
-
光气又称碳酰氯,有剧毒,可发生反应: COCl2(g) CO(g) +Cl2(g) ∆H>0。当反应达到平衡时,下列措施不能提高COCl2转化率的是
CO(g) +Cl2(g) ∆H>0。当反应达到平衡时,下列措施不能提高COCl2转化率的是
A. 升温 B. 恒容通入惰性气体 C. 减压 D. 恒压通入惰性气体
-
COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。
Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。

下列相关说法中不正确的是
A.1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B.若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C.12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D.以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
-
COCl2(g)  CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
A.①④⑥ B.①②④ C.②③⑥ D.③⑤⑥
-
T℃时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO) = 0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.11 mol·L-1,则反应的ΔH < 0
C.T℃时起始向容器中充入0.9 mol COCl2、0.20 mol Cl2和0.20 mol CO,达平衡前v正 > v逆
D.恒温恒容下,平衡后向体系内加入少量惰性气体,氯气的浓度不变
-
T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g) Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%
-
一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol |
| CO | Cl2 | COCl2 | COCl2 |
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
-
(8分)下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g);△H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g);△H1>0 K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H2<0 K2=5×104L·mol—1
COCl2(g);△H2<0 K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g) △H3 K3
CO(g)+Cl2(g) △H3 K3
④2SO2(g)+O2(g) 2SO3(g);△H4<0
2SO3(g);△H4<0
(1)反应③的平衡常数K3为________。
(2)要使反应①和反应②的K数值相等,可采取的措施是________(填序号)。
A.降低反应①、②体系中Cl2浓度 B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度 D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡。下列有关它们达到平衡状态后的叙述正确的是________(填序号)。
A.体积:甲可能小于乙 B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为15mol。现向容器中加入xmolSO2,6.5mol O2,2.0molSO3。
①若x=5.5,需要________(填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为。
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):



