-
化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.对硝基甲苯的结构简式:
B.离子结构示意图
既可以表示35Cl-,也可以表示37Cl-
C.NH5的结构与NH4Cl相似,NH5的结构式:
D.CO2的比例模型:
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.25℃,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
B.标准状况下,22.4L NO与11.2L O2混合后气体的分子数为NA
C.标准状况下,22.4 L己烷中共价键数目为19NA
D.过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2 NA
难度: 中等查看答案及解析
-
下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:
B.向氯化铁溶液中通入过量二氧化硫:
C.银和稀硝酸反应
D.向氯水中加入碳酸钠:
难度: 中等查看答案及解析
-
下图是用来干燥、收集并吸收多余气体的装置,下列方案正确的是( )
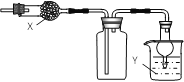
选项
X
收集气体
Y
A
氯化钙
氯化氢
水
B
碱石灰
氨气
水
C
碱石灰
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
①
的溶液:
②
的溶液中:
③水电离的
浓度
的溶液中:
④加入
能放出
的溶液中:
⑤使石蕊变红的溶液中:
⑥中性溶液中:
A.②④ B.只有② C.②④⑥ D.①②⑥
难度: 中等查看答案及解析
-
1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
难度: 简单查看答案及解析
-
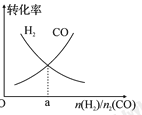
自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:

下列叙述正确的是
A.N2
NH3,NH3
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
难度: 中等查看答案及解析
-
有一种新化合物(如图所示),其中W、X、Y、Z 为同一短周期元素,Z 核外最外层电子数比X 核外电子数多1。下列叙述正确的是( )
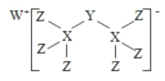
A.WZ 的熔点低于XZ4
B.元素非金属性的顺序为
C.该新化合物中Y 不满足8 电子稳定结构
D.Y 的最高价氧化物的水化物是强酸
难度: 中等查看答案及解析
-
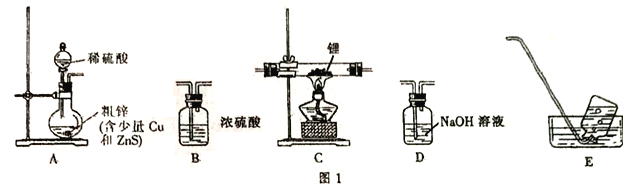
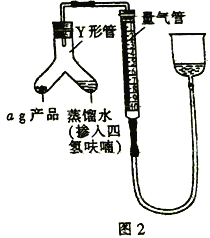
下列实验装置设计正确且能达到实验目的的是( )
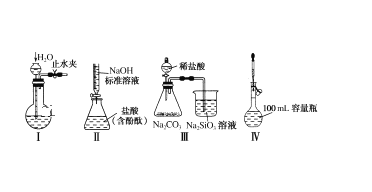
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
难度: 中等查看答案及解析
-
下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H = -38.6kJ•mol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJ•mol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJ•mol-1,则O2比O3稳定
难度: 中等查看答案及解析
-
一定温度下,反应
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
难度: 中等查看答案及解析
-
我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )
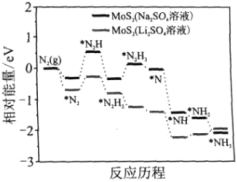
A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
难度: 中等查看答案及解析
-
为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是( )
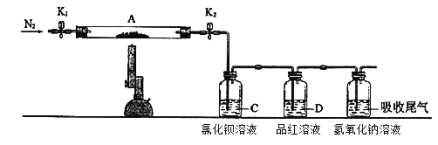
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
难度: 困难查看答案及解析
-
已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3
H2SO3
HClO
K1=4.30×10-7
K1=1.54×10-2
K=2.95×10-8
K2=5.61×10-11
K2=1.02×10-7
下列说法正确的是( )
A.相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B.向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
C.NaClO溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D.Na2CO3溶液中通入少量SO2:2CO32- + SO2+ H2O = 2HCO3 - + SO3 2-
难度: 中等查看答案及解析
-
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2mol,则NaOH的浓度为
A.2mol/L B.1.8mol/L C.2.4 mol/L D.3.6 mol/L
难度: 困难查看答案及解析