-
化学与社会、科学、技术、环境等有密切联系。下列有关说法正确的是
A.PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
B.油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量
C.为了防止食品受潮变质,常在食品包装袋中放入活性铁粉
D.用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法正确的是
A.12 g NaHSO4固体中含有的离子数为0.3 NA
B.足量Cl2与5.6 g Fe完全反应时,转移的电子数为0.2 NA
C.标准状况下,0.56 L 丙烷中含有的共价键数为0.25 NA
D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜
难度: 中等查看答案及解析
-
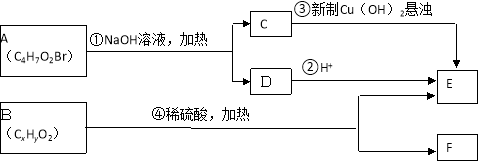
分子式为C9H18O2的有机物在酸性条件下可水解为酸和醇,且酸与醇的相对分子质量相等。若不考虑立体异构,这些酸和醇重新组合可形成的酯共有
A.12种 B.16种 C.20种 D.24种
难度: 中等查看答案及解析
-
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO
、K+
稀硫酸
3Fe2++NO
+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
氢氧化钠溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO
、Cl-
氢氧化钠溶液
HCO
+ OH-=CO
+H2O
D
Al3+、Cl-、NO
过量氢氧化钠溶液
Al3++3 OH-=Al(OH)3↓
难度: 中等查看答案及解析
-
下列有关叙述正确的是 ( )
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO
)+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-)
难度: 困难查看答案及解析
-
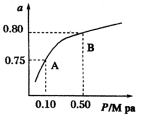
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是( )
X
Y
Z
W
A.原子半径:Z>W>X
B.若Z的最高价氧化物与Y的气态氢化物溶液混合后有气体放出,则W的气态氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见的液态化合物,则W单质溶于水形成的溶液有漂白性
难度: 中等查看答案及解析
-
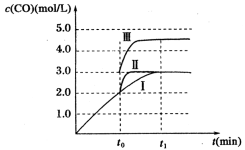
下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是 ( )
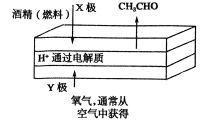
A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时处电路电子流向为X→Y
C.检测结束后,X极区的pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
难度: 中等查看答案及解析