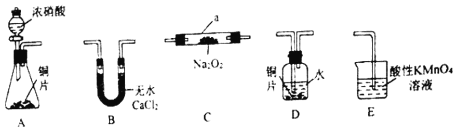
-
下列关于物质性质的说法不合理的是
A.FeC13、Na2O2、Cu2S均可由相应单质直接化合生成
B.C12、SO2气体通入紫色石蕊试液中,均出现溶液先变红后褪色
C.金属Mg与稀硫酸和CO2均能反应,其反应类型相同
D.氢氧化铝、碳酸铵、碳酸氢钠都既能与盐酸反应,又能与氢氧化钠溶液反应
难度: 简单查看答案及解析
-
化学在生产、生活中有着重要用途,下列对物质的用途、解释都正确的是
选项
物质
用途
解释
A
H2O2
消毒剂
H2O2具有强氧化性,可杀菌
B
SiO2
计算机芯片
SiO2是一种良好的半导体
C
Fe3O4
红色涂料
Fe3O4是一种红色氧化物
D
浓H2SO4
干燥剂
浓H2SO4有脱水性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.存在化学键断裂的变化一定是化学变化
B.酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物
C.纳米铁粉可以高效地去除被污染水体中的pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D.石油的分馏和煤的气化、液化均为物理变化
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.己知:正丁烷(g)=异丁烷(g) △H<0,则正丁烷比异丁烷稳定
B.己知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=-1478.8k·mol-1,则C2H4的燃烧热△H=-1478.8kJ·mol-1
C.己知:H+(aq)+OH-(aq)==H2O(1) △H=-57.3kJ· mol-1,但稀Ba(OH)2(aq)和稀H2SO4(aq)完全反应生成1molH2O(1)时,放出的热量大于57.3kJ
D.已知:S(g)+O2(g)==SO2(g) △H1;S(s)+O2(g)==SO2(g) △H2,则△H1>△H2
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4中滴加少量 Cu(NO3)2溶液
B.N2(g)+3H2(g)
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA
B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.2gCaH2与水完全反应,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氢氧化镁与硫酸的反应:OH-+H+=H2O
B.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.用氨水吸收过量的二氧化硫:OH-+SO2=HSO3-
D.向0.5mol·L-1KAl(SO4)2溶液中滴入0.5mol·L-1Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++4OH-+A1 3++2SO42-=2BaSO4↓+A1O2-+2H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B. 滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C. 0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、SO42-
D. 水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 中等查看答案及解析
-
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸(H3AsO4)和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是
A.该反应中被氧化的元素只有S
B.该反应中每析出4.8g硫黄,则转移0.5mol电子
C.该反应的氧化剂和还原剂物质的量之比为6:1
D.红棕色气体在该原电池的负极区生成并逸出
难度: 中等查看答案及解析
-
某混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气。下列说法正确的是
A.将溶液蒸干最多可以得到4 mol NaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1-
难度: 中等查看答案及解析
-
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是
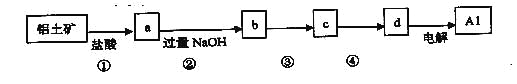
A.①、②中除加试剂外,还需要进行过滤操作 B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气 D.④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析
-
常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
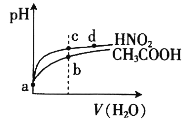
A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.从c点到d点,溶液中
的值保持不变
C.溶液中水的电离程度:b>c
D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
难度: 中等查看答案及解析
-
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是
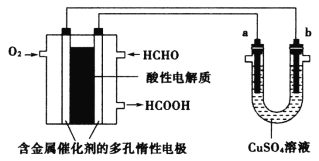
A.燃料电池工作时,负极反应为HCHO+H2O-4e-=CO2+4H+
B.当燃料电池消耗2.24L甲醛气体时,电路中理论上转移0.2mole-
C.当a、b都是铜电极时,电解的总反应方程式为:2CuSO4+2H2O
2H2SO4+2Cu+O2↑
D.电解后,消耗的甲醛和a电极上析出物质的物质的量相等
难度: 中等查看答案及解析
-
某充电宝锂离子电池的总反应为
。某手机镍氢电池总反应为
(M为储氢金属或合金),有关上述两种电池的说法错误的是

A.锂离子电池放电时,Li+移向正极
B.如图表示用锂离子电池给镍氢电池充电
C.锂离子电池充电时,阴极的电极反应式:
D.镍氢电池放电时,正极的电极反应式:
难度: 中等查看答案及解析
-
25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]-Ksp[Fe(OH)2],下列说法正确的是
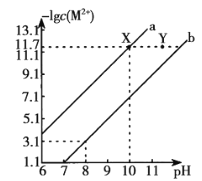
A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2 和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):c(Cu2+)= l:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
难度: 困难查看答案及解析
-
将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
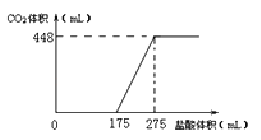
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
难度: 中等查看答案及解析