-
对于可逆反应:2A(g)+B(g)⇌2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.化合物SO2的水溶液能导电,因此SO2是电解质
B.已知1mol/L的乙酸溶液的pH约为2,说明乙酸是弱电解质
C.强电解质水溶液的导电性一定比弱电解质强
D.需要加热的反应一定是吸热反应
难度: 简单查看答案及解析
-
从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
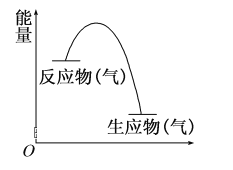
A.这是一个放热反应
B.该反应可能需要加热
C.生成物中的总键能高于反应物中的总键能
D.反应物比生成物更稳定
难度: 简单查看答案及解析
-
已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol 现有下列反应
(1)H2SO4(aq)+2NaOH (aq)=Na2SO4(aq)+2H2O(l);
(2)H2SO4(aq)+Ba(OH)2 (aq)=BaSO4(s)+2H2O(l);
(3)HCl (aq)+NH3•H2O (aq)=NH4Cl (aq)+H2O(l);
(4)CH3COOH (aq)+NaOH (aq)=CH3COONa (aq)+H2O(l);
其中反应热符合△H=-57.3kJ/mol的是( )
A.(1)(2) B.(2)(3) C.(3)(4) D.都不符合
难度: 简单查看答案及解析
-
25℃和1.01×105Pa时,反应2N2O5(g)
4NO2(g)+O2(g) △H=+56.76kJ/mol自发进行的原因是
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于能量效应
难度: 简单查看答案及解析
-
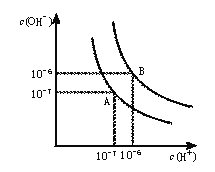
常温下,某溶液中由水电离产生的c(H+)、c(OH −)满足c(H+)·c(OH−)=10 −24,则下列各组离子在该溶液中一定可以大量共存的是( )
A.K+、Na+、CH3COO ̶、Cl − B.Na+、Cl −、SO42 ̶、HCO3 –
C.Ba2+、Na+、Cl−、NO3 − D.NH4+、Na+、NO3−、SO42−
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是
A.
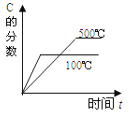
B.
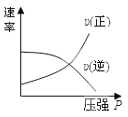
C.
D.
难度: 中等查看答案及解析
-
pH相等、体积相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出气体一样多,则下列说法正确的是
A.反应开始时的速率:甲=乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲=乙
D.反应结束时,溶液pH:甲<乙
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:A(g)+B(g)
R(g)+2D,此反应符合下面图像,下列叙述正确的是( )
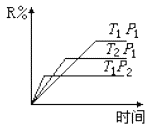
A.正反应吸热,D是气体 B.正反应吸热,D是固体或液体
C.正反应放热,D是气体 D.正反应放热,D是固体或液体
难度: 简单查看答案及解析
-
在一定条件下发生反应:3A(g)+ 2B(g)
xC(g)+2D(g),在 2L 的密闭容器中,把 4molA 和 2molB 混合,2min后达到平衡时生成 1.6molC,又测得反应速率 v(B)= 0.2mol·(L·min)-1,下列说法正确的是( )
A.A的平衡浓度是2.8mol·L-1 B.B 的转化率是20%
C.x= 4 D.平衡时气体压强是原来的 0.9倍
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
纯净物
混合物
强电解质
弱电解质
非电解质
A
大理石
玻璃
氯化钾
高氯酸
干冰
B
盐酸
水煤气
硫酸
醋酸
氯气
C
明矾
水泥
苛性钠
亚硫酸
熟石灰
D
冰醋酸
漂白粉
BaSO4
氟化氢
氨气
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知醋酸溶液中存在:CH3COOH
CH3COO− + H+,改变下列条件能增大醋酸电离度的是( )
①加热;②通入HCl气体;③加NaOH(s);④加CH3COONa(s);⑤加CH3COOH;⑥加水。
A.①③④⑥ B.①③⑥ C.①②④ D.①③⑤⑥
难度: 中等查看答案及解析
-
用0.01mol/LNaOH溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
A.硫酸 B.盐酸 C.醋酸 D.高氯酸
难度: 简单查看答案及解析
-
常温下,现有PH=2的某酸HX溶液和PH=12某碱YOH溶液,两溶液混合后,溶液的pH小于7.下表中判断合理的是( )
编号
HX
YOH
溶液的体积关系
A
强酸
强碱
V(HX)=V(YOH)
B
强酸
强碱
V(HX)<V(YOH)
C
强酸
弱碱
V(HX)=V(YOH)
D
弱酸
强碱
V(HX)=V(YOH)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知NaHSO4在水中的电离方程式为:NaHSO4 = Na+ + H+ + SO42—。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
难度: 简单查看答案及解析
-
下面是一段关于酸碱中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次 ②在一锥形瓶中加入25.00 mL待测NaOH溶液 ③加入几滴石蕊试剂作指示剂 ④取一支酸式滴定管,洗涤干净 ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定 ⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶 ⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点。文中所述操作有错误的序号为
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
难度: 简单查看答案及解析