-
习近平总书记在党的十九大报告中提出建设生态文明是中华民族永续发展的千年大计,到本世纪中叶把我国建成富强民主文明和谐美丽的社会主义现代化强国。二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
Ⅰ、利用水煤气合成二甲醚的三步反应如下:① 2H2(g) + CO(g)  CH3OH(g) ΔH=-90.8 kJ·mol-1,② 2CH3OH(g)
CH3OH(g) ΔH=-90.8 kJ·mol-1,② 2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1,③ CO(g) + H2O(g)
CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1,③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1,总反应:3H2(g) + 3CO(g)
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1,总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=____;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)。
CH3OCH3(g) + CO2 (g)的ΔH=____;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)。
a.高温高压 b.加入催化剂 c.增加H2的浓度 d.增加CO的浓度 e.分离出二甲醚
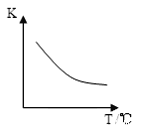
Ⅱ、工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g),已知该反应平衡常数(K)与温度(T)的关系如图所示.
CH3OCH3(g)+3H2O(g),已知该反应平衡常数(K)与温度(T)的关系如图所示.
(1)一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是__(选填编号)。
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有1molH2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
(2)温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将____(填“变大”、“变小”或“不变”),该反应的ΔH___0(填“ > ” 或 “ < ”)。
(3)一定温度下,向体积为2L的恒容容器中通入6molH2与2molCO2,2分钟后达到平衡时,容器中含有0.3mol二甲醚.则达到平衡时H2的转化率为___,0—2min内用CO2浓度的变化表示的化学反应速率为__。
-
党的十九大报告提出了“将我国建成富强、民主、文明、和谐、美丽的社会主义现代化强国”,其中增加了“美丽”一词,下列说法不符合这一主题思想的是( )
A. 对城市生活污水脱氮、除磷,净化处理,遏制水体富营养化
B. 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染
C. 实施矿物燃烧“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物对环境的污染
D. 大力开采煤和石油,促进地方经济发展
-
党的十九大报告提出了“将我国建成富强、民主、文明、和谐、美丽的社会主义现代化强国”,其中增加了“美丽”一词,下列说法不符合这一主题思想的是
A. 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染
B. 对城市生活污水脱氮、除磷,净化处理,遏制水体富营养化
C. 加强煤和石油的开采,促进地方经济发展
D. 实施矿物燃烧“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物对环境的污染
-
党的十九大报告中提出加快生态文明体制改革,建设美丽中国,坚持人与自然和谐共生。下列有关观念或做法不宜提倡的是
A. 青山绿水就是金山银山 B. 创建环境友好型社会人人有责
C. 大力开发森林资源,发展乡村旅游 D. 积极做好治沙工作,做到人进沙退
-
党的十九大报告提出“加快生态文明体制改革,建设美丽中国”,发展清洁能源对建设美丽中国具有重要意义。氢能是一种高效清洁、极具发展潜力的能源。
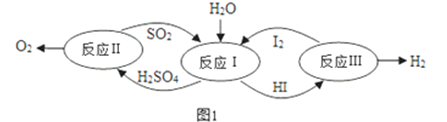
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图1所示:
①反应Ⅰ的离子方程式是______________________________________________;反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层。经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是 _______________________ 。
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+ 2H2O(g)△H = +550kJ•mo1-1,它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+ H2O(g)△H = +177kJ•mo1-1,ⅱ.SO3(g)分解,写出SO3(g)分解的热化学方程式 ______________________________。
(2)工业上利用反应C(s)+2H2O(g) CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
①T1℃时,该反应的平衡常数K= ______ ;T1 ______ T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量浓度 ______(填选项字母)。
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
(3)工业上还可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,
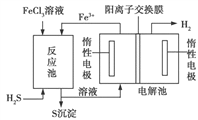
①反应池中反应物的流向采用气、液逆流方式,其目的是____________________;
②反应池中发生反应后的溶液进入电解池,电解总反应的离子方程式为_____________。
-
“十九大”报告中提出“建设美丽中国,推进绿色发展”。下列做法不符合这一宗旨的是
A. 大力推行“煤改气”等清洁燃料改造工程
B. 严禁乱弃废电池,防止重金属污染土壤和水源
C. 使用填埋法处理未经分类的生活垃圾
D. 用O3替代Cl2作饮用水消毒剂
-
十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如图,下列说法正确的是( )
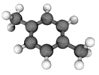
A.“PX”属于脂环烃
B.“PX”的二氯代物共有7种(不考虑立体异构)
C.“PX”分子中,最多有12个原子共面
D.“PX”的同系物均可使酸性KMnO4溶液褪色
-
十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是
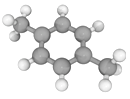
A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
-
十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是
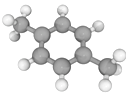
A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
-
“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是 ( )
A. 推广“低碳经济”,减少温室气体的排放
B. 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境
C. 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
D. 关停化工企业,消除污染源头
CH3OH(g) ΔH=-90.8 kJ·mol-1,② 2CH3OH(g)
CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1,③ CO(g) + H2O(g)
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1,总反应:3H2(g) + 3CO(g)
CH3OCH3(g) + CO2 (g)的ΔH=____;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)。
CH3OCH3(g)+3H2O(g),已知该反应平衡常数(K)与温度(T)的关系如图所示.





