-
中华传统文化博大精深,其中涉及很多的化学知识。下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“司南之杓(勺),投之于地,其柢(柄)指南”。司南中”杓”所用材质为Fe2O3
D.古剑“沈卢” “以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 简单查看答案及解析
-
下列各组性质比较中,正确的是()
①沸点:
②离子还原性:
③酸性:
④金属性:
⑤气态氢化物稳定性:
⑥半径:
A.①②③ B.③④⑤⑥ C.②③④ D.①③④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
B.SO2能使品红溶液、溴水褪色,分别说明SO2具有强氧化性、还原性
C.将AlCl3溶液和Al2(SO4)3溶液分别蒸干和灼烧,最终所得产物的成分均为Al2O3
D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. Fe
FeCl2
Fe(OH)2 B. S
2SO2
H2SO4
C. CaCO3
CaO
CaSiO3 D. NH3
NO
HNO3
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.将SO2通入BaCl2溶液中至饱和,无沉淀产生;若再通入NH3,则产生沉淀
D.纯锌与稀硫酸反应时加入少量CuSO4固体,速率会加快
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是
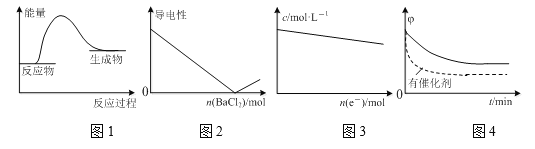
A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法正确的是( )
①在标准状况下,NA个SO3分子所占的体积为22.4L
②S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
③标准状祝下,22.4LNO和11.2LO2混合后气体的分子总数为1.5 NA
④1molAlCl3溶于1L的水中,所得溶液含有1NAAl3+
⑤在标准状况下,22.4LCl2与足量的氢氧化钾溶液反应转移的电子数为NA
⑥100mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是0.5NA
A.②⑤ B.①②④⑥ C.③⑤⑥ D.①②⑤⑥
难度: 中等查看答案及解析
-
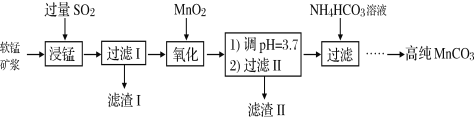
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
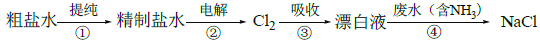
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
下列实验方案、现象、得出的结论均正确的是( )
选项
实验及现象
结论
A
用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰
该样品含钠元素
B
向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生
证明非金属性Cl>C
C
向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀
证明SO2被氧化为SO42-
D
常温下向氯化铵溶液中加入少量氨水使溶液至中性
c(NH4+)=c(Cl-)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A.①③⑤ B.②④ C.②⑤⑥ D.④⑤
难度: 中等查看答案及解析
-
现有室温下四种溶液,有关叙述不正确的是
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.分别取③、④溶液等体积加入足量的锌粒,产生氢气的量③>④
C.分别加水稀释10倍,四种溶液的pH ①>②>④>③
D.V1 L① 与V2 L ④混合,若混合后溶液pH=7,则V1=V2
难度: 中等查看答案及解析
-
某温度下,在体积可变的容器中发生反应:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
压强
P1
P2
P3
n/mol
①2.0molCO2 6.0molH2
0.10mol
0.04mol
0.02mol
②1.0molCO2 3.0molH2
x 1
y 1
z 1
③1.0molCH3OCH3 3.0molH2O
x 2
y 2
z 2
A.P1>P2 B.x 1=0.05
C.P2条件下,③中CH3OCH3平衡转化率为96% D.若该反应可自发进行,则高温更有利
难度: 简单查看答案及解析
-
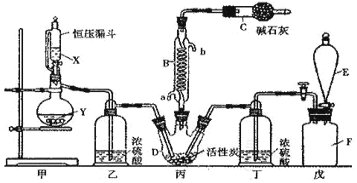
用下列实验装置进行相应实验,能达到实验目的的是
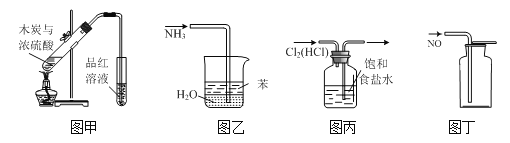
A.用图甲所示装置验证反应生成二氧化硫
B.用图乙装置吸收氨气并防止倒吸
C.用图丙装置除去氯气中的氯化氢
D.用装置丁收集NO
难度: 中等查看答案及解析
-
工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+
O2(g)
CO(g) ∆H4=-111kJ/mol
②H2(g)+
O2(g)=H2(g) ∆H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) ∆H2=-394kJ/mol
下列说法不正确的是( )
A.25℃时,
B.增大压强,反应①的平衡向逆反应方向移,平衡常数K减小
C.反应①达到平衡时,每生成
的同时生成0.5molO2
D.反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
难度: 中等查看答案及解析
-
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是
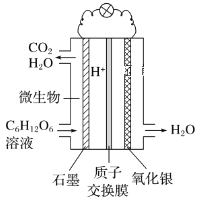
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每转移4 mol电子,石墨电极产生22.4 L CO2气体
D.每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是 ( )
A.石灰石溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全: Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
C.将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
D.稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
难度: 中等查看答案及解析
-
短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
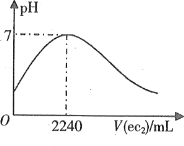
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa固体后c(CH3COO-)/c(Na+)变大
B.向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),则c(H+)/c(H2A)先变大后变小
C.已知:FeCl3(aq)+ 3KSCN(aq)
3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
D.室温时,0.1mol/L NH4HCO3溶液pH=8.1,则Ka1(H2CO3) >Kb(NH3·H2O)>Ka2(H2CO3)
难度: 简单查看答案及解析
-
下列对图像的叙述正确的是
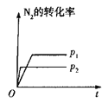
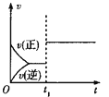
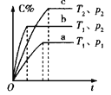
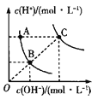
甲 乙 丙 丁
A.图甲可表示压强对反应:
的影响
B.图乙中,
时刻改变的条件一定是加入了催化剂
C.若图丙表示反应:
,则
、
D.图丁表示水中
和
的关系,ABC所在区域总有
难度: 困难查看答案及解析
-
Mn2+催化H2O2分【解析】
2H2O2(l)=2H2O(l)+O2(g) ΔH1,其反应机理如图。若反应Ⅱ的焓变为ΔH2,则反应Ⅰ的焓变ΔH为(反应Ⅰ、Ⅱ的计量数均为最简整数比)( )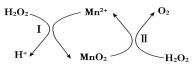
A.ΔH1-ΔH2 B.ΔH1+ΔH2
C.2ΔH1-ΔH2 D.ΔH1-2ΔH2
难度: 简单查看答案及解析
-
25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色)
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A.充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B.充电时,阳极附近溶液由绿色逐渐变为紫色
C.放电时,负极反应为V2+-e-=V3+
D.放电过程中,正极附近溶液的酸性减弱
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.图甲
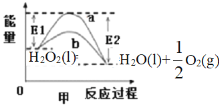 中,b曲线的热化学方程式为:H2O2(l)=H2O(l)+
中,b曲线的热化学方程式为:H2O2(l)=H2O(l)+O2(g)△H=(E1-E2)kJ/mol
B.图乙
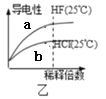 表示氢氟酸为弱酸,且a点与b点的
表示氢氟酸为弱酸,且a点与b点的数值相同
C.图丙
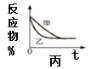 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
D.图丁
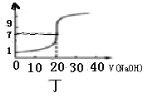 表示0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液的滴定曲线
表示0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液的滴定曲线难度: 简单查看答案及解析
-
下列叙述中不正确的是( )
A.0.1mol/L NaHCO3 溶液与 0.1mol/L NaOH 溶液等体积混合,所得溶液中:c(Na +) >c (CO32-) >c (HCO3-) >c(OH-)
B.中和等浓度等体积的盐酸和醋酸溶液,消耗NaOH的物质的量相同
C.25℃时,向0.1 mol·L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变
D.等pH值的①(NH4)2SO4溶液②NH4HSO4溶液③NH4Cl溶液中,c(NH4+)的大小关系:①=③>②
难度: 简单查看答案及解析