-
化学与人类生产、生活、社会可持续发展密切相关。下列说法不正确的是
A.煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放
B.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关
C.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
D.漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA。
B.标准状况下,5.6 LNO和5.6 LO2混合后的分子总数为0.5NA
C.1 L 0.1 mol•L-1的氨水含有0.1NA个OH-
D.1 mol Fe溶于过量稀硝酸,电子转移数为3NA
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,X+和Y3+的电子层结构相同,Z-的电子数比Y3+多8个,下列叙述正确的是
A.W在自然界只有一种核素 B.半径大小:X+>Y3+>Z-
C.Y与Z形成的化合物的水溶液呈弱酸性 D.X的最高价氧化物对应的水化物为弱碱
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
除去NO2中的NO气体
将气体通入装有水的洗气瓶中
B
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
D
除去FeCl2溶液的FeCl3
加入过量铁粉,然后过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C.碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.硫酸铝溶液中加入过量氨水: Al3++3OH-=Al(OH)3↓
难度: 中等查看答案及解析
-
关于下列各装置的叙述中,正确的是
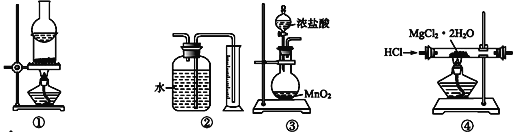
A.装置①可用于分离I2与NH4Cl的混合物
B.装置②用于收集并测量Cu与浓硫酸反应产生的气体的体积
C.装置③用于制取氯气
D.装置④用于制取无水MgCl2
难度: 中等查看答案及解析
-
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
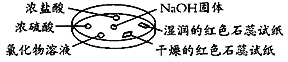
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应生成了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
A. A B. B C. C D. D
难度: 中等查看答案及解析