-
在中和反应反应热的测定实验中,不需要用到的仪器是
A.玻璃棒 B.烧杯 C.温度计 D.环形玻璃搅拌棒
难度: 简单查看答案及解析
-
下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+
O2
H2O(l) △H=-285.8kJ·mol-1
难度: 中等查看答案及解析
-
下列有关电解原理的说法正确的是
①电解是把电能转变为化学能 ②电解是把化学能转变为电能 ③电解质溶液的导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①③④ B.②③⑤ C.③④ D.①③④⑤
难度: 简单查看答案及解析
-
全世界每年都有大量的金属设备和金属材料因腐蚀而报废,下列关于金属的腐蚀与防护说法错误的是( )
A.海边的铁制品易形成电化学腐蚀而生锈
B.高架电线杆将锌与钢铁相连构成以铁为负极的原电池来防腐
C.金属表面喷漆可以大大减缓或避免发生腐蚀
D.水库的铁闸门采用的是外加电流阴极保护法来防止腐蚀
难度: 简单查看答案及解析
-
一定条件下,发生反应:①M(s)+N(g)
R(g) △H=—Q1 kJ/mol,②2R(g)+N(g)
2T(g) △H=—Q2 kJ/mol.Q1、Q2、Q3均为正值.下列说法正确的是 ( )
A.1mol R(g)的能量总和大于1mol M(s)与1mol N(g)的能量总和
B.将2mol R(g)与1mol N(g)在该条件下反应,可以放出热量Q2 kJ
C.当1mol M(s)完全转化为T(g)时(假定无热量损失),放出热量
D.M(g)+N(g)
R(g) △H=—Q3 kJ/mol,则Q3 >Q1
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:
A.H2的燃烧热为571.6kJ·mol-1
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-57.3kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9kJ·mol-1
难度: 中等查看答案及解析
-
对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间
水样
0
5
10
15
20
25
Ⅰ(pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ(pH=4,含Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是( )
A.在
内,Ⅰ中M的分解速率为
B.水样酸性越强,M的分解速率越快
C.在
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于
存在,Ⅳ中M的分解速率比Ⅰ快
难度: 中等查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
某恒容密闭容器中充入1molPCl5气体,发生反应:PCl5(g)
PCl3(g)+Cl2(g) △H<0。仅改变某一条件,该平衡由状态I移动到状态II,变化曲线如图所示。可能改变的条件是
A.继续通入1mol PCl5气体 B.继续通入1mol PCl3气体
C.升高 D.加入催化剂
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
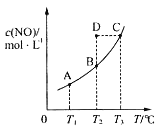
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
难度: 中等查看答案及解析
-
下列反应中一定不能自发进行的是( )
A.2KClO3(s)=2KCl(s)+ 3O2(g) △H<0,△S>0
B.CO(g)=C(s,石墨)+ O2(g) △H>0,△S<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0,△S<0
D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) △H>0,△S>0
难度: 简单查看答案及解析
-
在25℃时,用蒸馏水稀释1mol·L-1的氨水至0.01mol·L-1,随着溶液的稀释,下列各项比值中始终不变的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
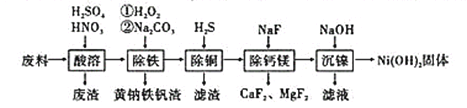
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
难度: 中等查看答案及解析
-
将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 L B.13.44 L C.3.36 L D.5.6 L
难度: 中等查看答案及解析
-
“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是
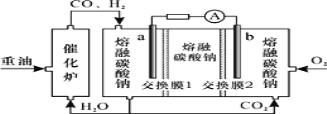
A.O2在b极得电子,最终被还原为CO32−
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32−经“交换膜2”移向b极
D.H2参与的电极反应为:H2−2e−+CO32−=H2O+CO2
难度: 困难查看答案及解析