-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
-
I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g) CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
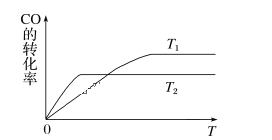
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
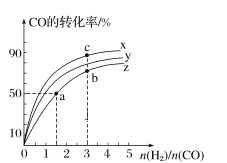
-
标准状态下,气态分子断开l mol化学键的焓变称为键能。已知H-H、H-O和O=O键的键能ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是( )
A.H2O (g)= H2(g)+ O2(g); ΔH= -485 kJ/mol
O2(g); ΔH= -485 kJ/mol
B.2H2(g)+ O 2(g)=2H2O(g) ΔH = -485 kJ/mol
C. 2H2(g)+ O2 (g)= 2H2O(g) ΔH = +485 kJ/mol
D.H2O (g)=H2(g)+ O2(g); ΔH==+485 kJ/mol
O2(g); ΔH==+485 kJ/mol
-
标准状况下,气态分子断开1mol化学键所需的能量称为键能。 已知H—H,H—O,和O==O键的键能分别为 436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) △H =-485KJ/mol
B. H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C. 2H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D. 2H2(g) + O2(g)==2H2O(g) △H =-485KJ/mol
-
标准状态下,气态分子断开1mol化学键的焓变为键焓.已知 H﹣H, H﹣O 和O=O 键的键焓△H分别为 436kJ•mol﹣1、 463kJ•mol﹣1 和 495kJ•mol﹣1.下列热化学方程式正确的是( )
A.H2O(g) ═H2(g)+1/2O2(g) △H=﹣485kJ•mol﹣1
B.H2O(g)═H2(g)+1/2O2(g) △H=+485kJ•mol﹣1
C.2H2(g)+O2(g)═2H2O(g) △H=+485kJ•mol﹣1
D.2H2(g)+O2(g)═2H2O(g) △H=﹣485kJ•mol﹣1
-
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=-485KJ/mol
B. H2O(g)=H2(g)+1/2O2(g) ΔH=+485KJ/mol
C. H2(g)+1/2O2(g)=H2O(g) ΔH=-485KJ/mol
D. 2H2(g)+O2(g)=2H2O(g) △H=-485KJ/mol
-
标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1、495 kJ·mol-1,下列热化学方程式正确的是( )
O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1、495 kJ·mol-1,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=-485 kJ·mol-1
B. H2O(g)=H2(g)+ 1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=-485 kJ·mol-1
-
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O和O=O键的键焓△H分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) △H =-485kJ/mol
B.H2O(g)=H2(g)+1/2O2(g) △H =+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g) △H =+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol
CH3OH(g)。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

