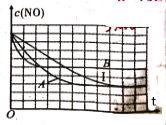
-
下列有关有效碰撞模型说法正确的是( )
A.有效碰撞是发生化学反应的充要条件 B.能发生有效碰撞的分子不一定是活化分子
C.不存在活化能为零的反应 D.活化分子间的碰撞一定是有效碰撞
难度: 简单查看答案及解析
-
醋酸是常见的弱酸,下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是( )
A.滴加少量浓盐酸 B.加入少量的冰醋酸
C.滴加饱和食盐水 D.加入少量醋酸钠固体
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g) = 2H2O(g) △H= -483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.已知C2H4(g) = C2H2(g)+H2(g) △H>0,则乙炔比乙烯稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则表示该反应中和热的离子方程式为:OH-(aq)+H+(aq) = H2O(aq) △H= -57.3kJ·mol-1
D.已知C(s)+O2(g) = CO2(g) △H1;C(s)+1/2O2(g) = CO(g) △H2。则△H1<△H2
难度: 简单查看答案及解析
-
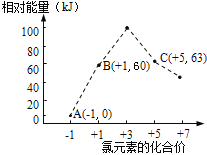
下列形式表示的反应为放热反应的是( )
A.
B.
C.
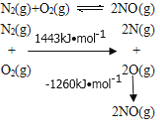
D.
难度: 困难查看答案及解析
-
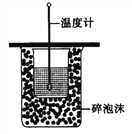
下列有关实验内容、实验装置和对应的实验目的均正确的是
A.测定中和热
B.比较Cu2+、Fe3+对反应速率的影响
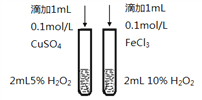
C.比较醋酸和硼酸的酸性强弱
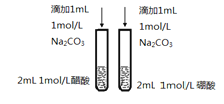
D.比较温度对化学反应速率的影响
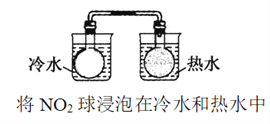
难度: 中等查看答案及解析
-
国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g)
CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
A.该反应的△S<0 B.正反应速率增大,逆反应速率也增大且增加的倍数更大
C.化学平衡常数K增大 D.CH4的产率降低
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.
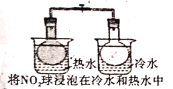 气体在热水中比在冷水中颜色深
气体在热水中比在冷水中颜色深B.
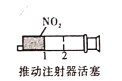 加压后气体颜色先变深后变浅
加压后气体颜色先变深后变浅C.
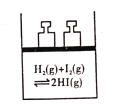 平衡体系加压后颜色变深
平衡体系加压后颜色变深D.
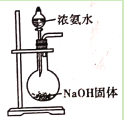 用浓氨水和NaOH固体制取氨气
用浓氨水和NaOH固体制取氨气难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.C3H6Cl2有3种同分异构体 B.由乙烯生成乙醇属于加成反应
C.2一甲基丁烷也称异丁烷 D.油脂、蛋白质和聚乙烯都属于高分子化合物
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A.向Na2SiO3溶液中通人少量CO2:SiO32-+CO2+H2O=H2SiO3+CO32-
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.足量的烧碱溶液与二氧化碳的反应:OH-+CO2=HCO3-
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
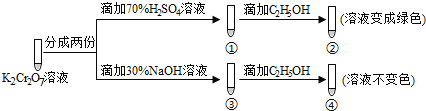
结合实验,下列说法错误的是( )
A.①中溶液橙色加深,③中溶液变黄 B.对比②和④可知K2Cr2O7酸性溶液氧化性强
C.②中C2H5OH使Cr2O72-被氧化 D.若向④中加入70%H2SO4溶液至过量,溶液可变为绿色
难度: 中等查看答案及解析
-
温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g)
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器
甲
乙
反应物
CO
H2O
CO
H2O
起始时物质的量(mol)
1.2
0.6
2.4
1.2
平衡时物质的量(mol)
0.8
0.2
a
b
A.乙容器中,平衡时,反应放出的热量为32.8kJ B.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍 D.乙容器中,平衡时H2O的转化率约为75%
难度: 困难查看答案及解析
-
下列实验方案能达到目的的是( )
A.除去NaCl溶液中混有的MgCl2:加入适量氨水后过滤
B.提纯混有少量硝酸钾的氯化钠:将混合物溶于热水中,再冷却、结晶并过滤、洗涤、干燥
C.实验室获取少量纯净的水:用蒸馏的方法来蒸馏自来水
D.提取碘水中的碘:可加入适量乙醇,振荡、静置、分液
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的一种盐是84消毒液的有效成分。下列说法正确的是( )
A.元素Z、W的简单离子具有相同的电子层结构
B.Y、Z、W的最高价氧化物对应的水化物之间能相互反应
C.X的简单气态氢化物的热稳定性比H2O的强
D.W形成的含氧酸的酸性一定比X形成的含氧酸的酸性强
难度: 中等查看答案及解析
-
早在西汉时期就有记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱,要加快该化学反应的速率,所采取的下列措施无效的是( )
A.增大硫酸铜的浓度 B.提高反应的温度
C.增大压强 D.用铁粉代替铁片
难度: 简单查看答案及解析
-
在2L的恒温恒压密闭容器中投入2molSO3发生反应:2SO3(s)
2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
A.用SO3表示的反应速率为0.2mol·L-1·min-1
B.若O2的体积分数不变,证明该可逆反应已达平衡
C.在2min时,v正(SO2)=2v逆(O2)
D.平衡后,再投入2 mol SO3,则正反应速度加快,逆反应速率不变
难度: 中等查看答案及解析
-
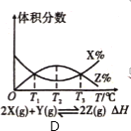
在容积固定的密闭容器中,以丙烯、氨、氧气为原料,在催化剂存在下生产丙烯腈(C3H3N),反应的热化学方程式为:2C3H6(g)+2NH3(g)+3O2(g)
2C3H3N(g)+6H2O(g) △H= -1030kJ·mol-1。在其他条件和反应时间相同时,丙烯腈产率与反应温度的关系曲线如图所示。下列有关说法错误的是( )
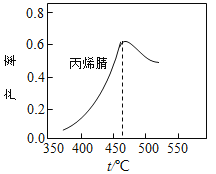
A.低于460℃时,丙烯腈的产率随温度升高而升高,是因为升高温度,反应速率加快
B.高于460℃时,丙烯腈的产率随温度升高而降低,可能与温度度升高,化学平衡逆向移动有关
C.其他条件不变,降低温度有利于提高丙烯腈平衡产率
D.投料比不变,增加反应物的浓度有利于提高丙烯腈平衡产率
难度: 困难查看答案及解析