-
下列表述中,说法正确的个数是
①pH=6的溶液一定是酸性溶液
②用Na2CO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③为保存FeCl3溶液,要在溶液中加少量盐酸
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑥0.2 mol/L醋酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
⑧用广范pH试纸测得某溶液的pH为2.3
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
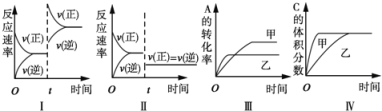
A.图I表示增加反应物浓度对该平衡的影响
B.图II表示减小压强对该平衡的影响
C.图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D.图IV表示催化剂对该平衡的影响,催化效率:甲>乙
难度: 简单查看答案及解析
-
在一个固定体积的密闭容器中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g)
3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molB B.3molC+ 1molD+ 1molB
C.6molC + 0.8molD D.1.6molA+0.8molB + 0.6molC+0.3molD
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列叙述,正确的是
A.液态HCl、固态NaCl均不导电,所以HCl和NaCl均为非电解质
B.NH3、SO3的水溶液均导电,所以NH3、SO3是电解质
C.蔗糖、酒精在水溶液中和熔融时均不导电,所以它们是非电解质
D.铜丝、石墨均导电,所以它们是电解质
难度: 简单查看答案及解析
-
H2O2是一种二元弱酸,对于0.1mol·L−1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2
H++HO2-,HO2-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
难度: 中等查看答案及解析
-
下列事实一定能说明HF是弱酸的是( )
①用HF溶液做导电性实验,灯泡很暗; ②HF与NaCl不能发生反应;③常温下0.1mol/L的HF溶液pH为2.3;④HF能与Na2CO3溶液反应,产生CO2 ;⑤ HF与水能以任意比混溶;⑥1mol/L的HF水溶液能使紫色石蕊试液变红
A.①② B.②③⑤ C.③④⑥ D.③
难度: 中等查看答案及解析
-
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
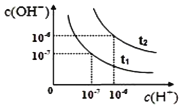
A.t1<t2
B.将t1温度下0.1 mol·L−1的盐酸稀释,溶液中所有离子的浓度均相应减小
C.一定温度下,改变水溶液中c(H+)或 c(OH−)的浓度,Kw不会发生变化
D.t2温度pH为2的HCl溶液中,水电离出的c(H+)=1×10−10mol·L−1
难度: 中等查看答案及解析
-
下列说法中正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.根据溶液的pH与酸碱性的关系,推出pH=6.8的溶液一定显酸性
C.常温下,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1:104
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
难度: 中等查看答案及解析
-
要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
难度: 中等查看答案及解析
-
下列各项中指定的比值为2:1的是
A.相同温度下2mol·L-1醋酸与1mol·L-1醋酸中的c(H+)之比
B.常温下,0.1mol·L-1Na2CO3溶液与0.1mol·L-1CH3COONa溶液中c(Na+)之比
C.碳酸中c(H+)与c(CO32-)之比
D.Na2CO3溶液中c(Na+)与c(CO32-)之比
难度: 中等查看答案及解析
-
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)
PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl3(g)
Cl2(g)
PCl5(g)
初始浓度/(mol•L-1)
2.0
1.0
0
平衡浓度/(mol•L-1)
c1
c2
0.4
A.10 min内,v(Cl2)=0.02 mol/( L•min)
B.升高温度,反应的平衡常数增大
C.反应达到平衡时容器内的压强与初始时容器的压强之比为1:2
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1
难度: 中等查看答案及解析
-
将BaO2放入密闭的真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变
C.BaO2量增加 D.氧气压强减小
难度: 中等查看答案及解析
-
25℃ 时纯水的电离度α1,pH=11的氨水中水的电离度为α2,pH=3的盐酸中水的电离度α3.若将上述氨水与盐酸等体积混合,所得溶液中的电离度为α4下列关系式中正确的是
A.α1<α2<α3<α4 B.α3=α2<α1<α4
C.α2<α3<α1<α4 D.α2=α3<α4<α1
难度: 中等查看答案及解析
-
某酸式盐NaHB的溶液在室温下呈弱碱性。下列说法正确的是
A.该盐的电离方程式为NaHB
Na++H++B2-
B.NaHB溶液中加入少量的NaOH,HB-的电离平衡常数增大
C.HB-的水解程度大于其电离程度
D.中和等物质的量的H2B和H2SO4,前者所需NaOH的量大于后者
难度: 中等查看答案及解析
-
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
A.两溶液中水的电离程度相同
B.c(Na+):①>②
C.两溶液分别用水稀释10倍后,pH①=pH②<9
D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+)
难度: 中等查看答案及解析
-
室温下,下列说法正确的是
A.醋酸分子不可能存在于pH>7的碱性溶液中
B.NaCl溶液与CH3COONH4溶液均呈中性,所以等物质的量浓度的两种溶液中水的电离程度相等。
C.0.1mol·L-1硫化钠溶液中粒子浓度的关系:c(OH-)- c(H+)=c(HS-)+c(H2S)
D.同浓度的溶液:①(NH4)2SO4、②NH4HSO4、③NH4Cl中,c(NH4+)由大到小的顺序是①>②>③
难度: 中等查看答案及解析
-
下列有关溶液中微粒浓度关系的叙述正确的是( )
A.物质的量浓度相等的HCN和NaCN的混合液(pH>7) 中:c(Na+)>c(CN-)>c(HCN)>c(OH-)
B.在pH=7的NH4Cl和NH3∙H2O的混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.0.1mol∙L-1的(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
D.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
难度: 中等查看答案及解析
-
在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大 B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小 D. 加入NaOH固体,溶液pH减小
难度: 简单查看答案及解析
-
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl−)>c(H+)>c(NH4+)>c(OH−)
D.B与D等体积混合后,溶液中有c(OH−)=c(CH3COOH)+c(H+)
难度: 中等查看答案及解析