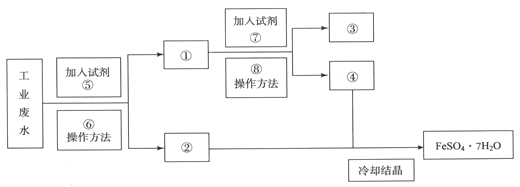
-
14C具有放射性,它能自发放出某种射线,而衰变成其他元素。考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年。下列考古遗址发现的遗物中能用14C测定年代的是( )
A.战国曾侯乙墓的青铜编钟(距今约2400年)
B.马家窑文化遗址的粟(距今约5300年)
C.秦始皇兵马俑(距今约2200年)
D.元谋人的门齿(距今约170万年)
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeCl3溶于1L水,加热,制得氢氧化铁胶体粒子数可以为NA
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.25℃时,0.1mol/L的HCl溶液所含H+ 约为0.1NA
难度: 中等查看答案及解析
-
下列有关合金的说法,错误的是 ( )
A.储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料
B.世界上用途最广,用量最大的合金是钢
C.合金的硬度一般比它的各成分金属的小,熔点一般也比它的各成分金属的高
D.合金可以由金属和非金属融合而成
难度: 简单查看答案及解析
-
某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是
A. Cl-、SO42-、Na+、K+ B. K+、ClO-、Na+、NO3-
C. HCO3-、Na+、NO3-、K+ D. NO3-、Ba2+、Cl-、NH4+
难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是 ( )
A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl D.50 mL 1 mol·L-1的CaCl2
难度: 中等查看答案及解析
-
将2g NaOH固体分别加入到100mL下列溶液中,溶液的导电能力变化最小的是( )
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L CH3COOH溶液 D.0.5mol/L KCl溶液
难度: 中等查看答案及解析
-
实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选用500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水 B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水 D.称取12.5 g胆矾配成500 mL溶液
难度: 中等查看答案及解析
-
在0℃ 1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是
A.其密度之比等于物质的量之比
B.其密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量的之比
D.等体积的三种气体,其物质的量之比等于相对分子质量之比
难度: 中等查看答案及解析
-
充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是
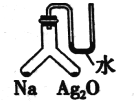
A.反应前后装置内空气的成分保持不变
B.反应前装置内钠与Ag2O物质的量之比为2:1
C.热稳定性:生成的钠的氧化物强于Ag2O
D.反应后有淡黄色固体生成
难度: 困难查看答案及解析
-
某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化) ( )
A.① B.①②④ C.①③⑤ D.①③④⑤
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.氢氧化铁胶体制备的化学方程式为:FeCl3+H2O
Fe(OH) 3 ↓+3HCl
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至过量:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.少量氯气通入溴化亚铁溶液中:Cl2+2Br- =Br2+2Cl-
D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
难度: 中等查看答案及解析
-
既能与盐酸反应又能与氢氧化钠溶液反应的化合物是( )
①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 ⑤CH3COONH4
A.①②③⑤ B.①④⑤ C.②③⑤ D.①③④
难度: 中等查看答案及解析
-
根据中学化学教材所附的元素周期表判断,在短周期元素中下列叙述错误的是( )
A.K层电子数为奇数的所有元素所在的族的序数与该元素原子的K层电子数相等
B.L层电子数为奇数的所有元素所在的族的序数与该元素原子的L层电子数相等
C.L层电子数为偶数的所有元素所在的族的序数与该元素原子的L层电子数相等
D.M层电子数为奇数的所有元素所在族的序数与该元素原子的M层电子数相等
难度: 中等查看答案及解析
-
在浓度均为3mol·L-1的H2SO4和NaOH溶液各100 mL中,分别加入等质量的铝粉,反应完毕后生成气体的质量比为4∶5,则加入铝粉的物质的量为( )
A.0.125mol B.0.25mol C.0.5mol D.1mol
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.质子数相同而中子数不同的同一种元素的不同原子互为同素异形体
B.铁是人体必需微量元素中含量最多的一种
C.在水溶液中能导电的物质一般是电解质,如HCl、H2O 、NH3、CH3COOH、NaOH、AgCl都是电解质
D.元素周期表中每一个纵列为一个族
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.1869年,俄国化学家门捷列夫将元素按照核电荷数由小到大依次排列,并将化学性质相似的元素放在一个纵列,制作出第一张元素周期表
B.稀土元素能大大改善合金的性能,被称为“冶金工业的维生素”
C.同位素在生产、生活和科研中有着广泛应用,如21H、31H是用于制造氢弹
D.碱金属熔点都比较低,导热性都很好,如液态钠可用作核反应堆的传热介质
难度: 中等查看答案及解析
-
将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A.若c1=2c2,则w1<2w2,V<50 mL
B.若c1=2c2,则w1<2w2,V>50 mL
C.若w1=2w2,则c1<2c2,V=50 mL
D.若w1=2w2,则c1>2c2,V<50 mL
难度: 简单查看答案及解析
-
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原,现用30.00 mL 0.049 mol/L羟胺的酸性溶液与足量硫酸铁溶液反应(反应Fe3+转变为Fe2+),生成的Fe2+恰好与24.50 mL 0.020 mol/L KMnO4酸性溶液完全作用:2KMnO4+6FeSO4+4H2SO4 =3Fe2(SO4)3+K2SO4+4H2O+2MnO2,则上述反应中羟胺的氧化产物为( )
A.N2 B.N2O C.NO D.NO2
难度: 中等查看答案及解析