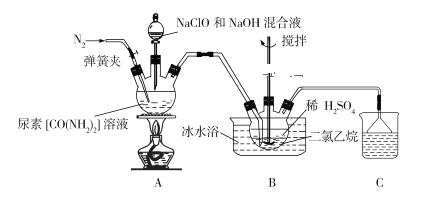
-
某有机物的结构简式如图所示,下列说法正确的是( )
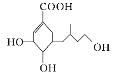
A. 分子式为C12H18O5 B. 分子中含有2种官能团
C. 只能发生加成反应和取代反应 D. 能使溴的四氯化碳溶液褪色
难度: 简单查看答案及解析
-
水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
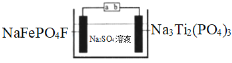
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
难度: 简单查看答案及解析
-
环境问题是当今社会备受关注的热点。下列观点不合理的是
A.酸雨情况能间接反映空气质量,与2017年相比2018年辽宁省城市降水pH增大0.29,空气质量呈现恶化趋势
B.“水漆”和“油漆”的最大区别在于溶剂不同。《“十三五”挥发性有机物污染防治工作方案》中明确提出,要大力推行水性涂料(即“水漆”)的使用,是因其具有节能环保、超低排放、低碳健康等特点
C.“隐形的污染物”臭氧开始取代PM2.5和PM10,成为我国一些地区夏季首要空气污染物。“臭氧超标”并不是由污染源直接排放的,臭氧是二次污染物
D.“指尖上的外卖”成为了塑料餐盒泛滥的“元凶”,进一步加强生活垃圾分类与再生资源回收的衔接是目前实现“绿色外卖”的有力解决方法之一
难度: 中等查看答案及解析
-
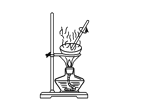
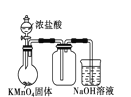
下列图示的实验操作,能实现相应实验目的的是 ( )
A. 蒸干CuCl2饱和溶液制备无水CuCl2
B. 实验室制取并收集少量纯净氯气
C. 研究催化剂对H2O2分解速率的影响
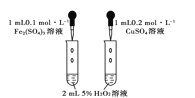
D. 验证甲烷和氯气在光照条件下发生取代反应
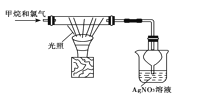
难度: 简单查看答案及解析
-
根据你的认知和体验,下列说法或做法不正确的是
①绿色食品就是不使用化肥农药,不含任何化学物质的食品②为使蔬菜保鲜,常在其表面洒少许福尔马林溶液③为了防止某些富脂食物因被氧化而变质,常在包装袋里放生石灰④酸雨是pH<7的雨水,主要是由大气中的SO2、NO2等造成的⑤75%酒精比无水乙醇用作医用消毒剂效果好⑥为了延长食品的保质期,向其中添加大量苯甲酸钠等防腐剂
A.②④⑤ B.①②③⑤⑥ C.①②③④⑥ D.②③④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol−1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)
2CO2(g)+2H2O(g) ΔH= −1411.3 kJ·mol−1
C.用石墨电极电解1 L 0.1 mol·L−1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
难度: 困难查看答案及解析
-
下列实验能达到其对应目的的是
实验
目的
A
用铂丝蘸取溶液进行焰色反应,透过蓝色钴玻璃观察火焰呈紫色
验证该溶液为钾盐溶液
B
取少量亚硫酸钠试样加水溶解,滴加氯化钡溶液,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
验证该亚硫酸钠试样已经变质
C
向蔗糖溶液中加几滴稀硫酸,水浴加热5 min后,再加新制氢氧化铜悬浊液加热,无砖红色沉淀生成
证明蔗糖没有水解
D
向实验室制备的乙酸乙酯中加入氢氧化钠溶液,振荡,分液
除去乙酸乙酯中的乙酸杂质
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
对下列叙述的评价合理的是
选项
叙述
评价
A
乙酸乙酯在H
O中水解,产物乙醇中将含有18O
对,根据酯的水解规律,产物乙醇中将含有18O同位素,而乙酸则没有
B
明矾和漂白粉都可用于水的净化
对,二者的作用原理相同
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
对,K2CO3与NH4Cl反应生成氨气会降低肥效
D
可以用新制的Cu(OH)2悬浊液鉴别乙醇、乙酸和葡萄糖
错,用新制的Cu(OH)2悬浊液不能鉴别乙醇和乙酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
酒石酸(RH2)分子的结构简式为:
 。它可以通过电渗析法制备。“三室电渗析”工作原理如图所示(电极均为惰性电极)。下列说法正确的是
。它可以通过电渗析法制备。“三室电渗析”工作原理如图所示(电极均为惰性电极)。下列说法正确的是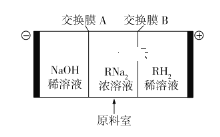
A.A为阴离子交换膜,B为阳离子交换膜
B.阴极每生成22.4 L的气体时,转移的电子数为2NA
C.阳极反应为2H2O + 4e−
O2↑+ 4H+
D.若用铅蓄电池作电源,当生成1 mol RH2时,理论上电源的负极增重96 g
难度: 困难查看答案及解析
-
将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:
,则参加反应的Fe和HNO3的物质的量之比为( )
A.5∶16 B.1∶1 C.2∶3 D.3∶2
难度: 中等查看答案及解析
-
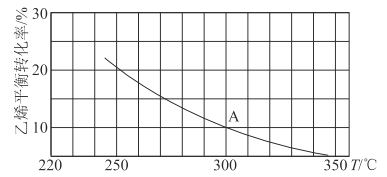
在刚性容器中发生反应:2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g),一定压强下,平衡时H2的转化率α(H2)随温度T、投料比
的变化关系如图所示。下列说法错误的是
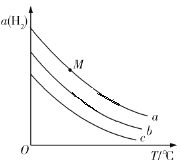
A.投料比
的大小关系是:a>b>c
B.图中M点对应的平衡,若容积不变,充入He,则α(H2)不变
C.该反应的平衡常数K(600 ℃)>K(500 ℃)
D.若题图表示相同投料时,不同压强下α(H2)随T的变化关系,则压强最大的是a
难度: 中等查看答案及解析
-
用如图所示装置进行实验,下列对实验现象的解释不合理的是
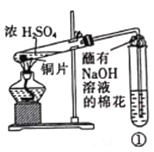
①中试剂
①中现象
解释
A
品红溶液
溶液褪色
SO2具有漂白性
B
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
C
酸性KMnO4溶液
紫色褪去
SO2具有还原性
D
酸性Ba(NO3)2溶液
生成白色沉淀
SO32-与Ba2+生成BaSO3沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某有机物X(
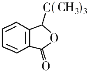 )是我国具有自主知识产权的国家一类新药的有效成分,下列关于X的说法错误的是
)是我国具有自主知识产权的国家一类新药的有效成分,下列关于X的说法错误的是A.1 mol X与足量H2发生加成反应消耗3 mol H2 B.与酸和与碱反应的类型相同
C.分子中所有碳原子在同一平面内 D.一氯取代物只有6种
难度: 中等查看答案及解析
-
下列各组粒子在溶液中可以大量共存,且加入或通入试剂M后,发生反应的离子方程式也正确的是
选项
微粒组
试剂M
发生反应的离子方程式
A
K+、Na+、
、
少量HCl
2H++
H2SiO3↓
B
、Fe2+、Br−、
过量H2S
Fe2++H2S
FeS↓+2H+
C
HClO、Na+、Fe3+、
过量CaCl2
Ca2++
CaSO3↓
D
、Cl−、K+、
少量CO2
CO2+2
+3H2O
2Al(OH)3↓+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
现有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
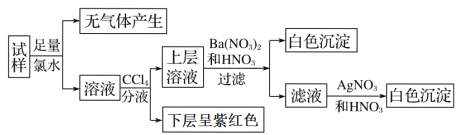
则关于原溶液的判断中不正确的是
A.是否存在 Na+、K+需要通过焰色反应来确定
B.通过CCl4 层的颜色变化,也能判断出原溶液中是否存在Fe3+
C.虽然实验过程引入了氯元素, 但不影响原溶液是否存在Cl-的判断
D.肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-
难度: 中等查看答案及解析
-
下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是




瓷器
丝绸
茶叶
酒
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用
难度: 简单查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
碳酸氢铵受热易分解
焙制糕点
B
蛋白质受热变性
高温杀死流感病毒
C
SO2具有漂白性
漂白滋补品银耳等食品
D
Al(OH)3分解吸收大量热量并有水生成
阻燃剂
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法正确的是
A.100 g 46%的乙醇溶液中,含H—O键的数目为NA
B.标准状况下,7.8 g乙炔和苯的混合物中含C—H键数目为0.6NA
C.1 L 0.1 mol·L−1 AlCl3溶液中含Al3+数目为0.1NA
D.将1 mol NH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
难度: 中等查看答案及解析
-
下列化学用语表示错误的是( )
A. S2-的结构示意图:
 B. N2H4的结构式:
B. N2H4的结构式: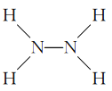
C. CaH2的电子式:[H:]-Ca2+[:H]- D. 乙烯的比例模型:
难度: 简单查看答案及解析
-
a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )
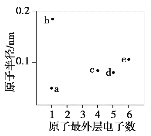
A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
难度: 中等查看答案及解析