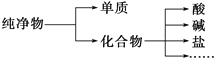
-
1998年诺贝尔化学奖授予科恩和波普尔,以表彰他们在理论化学领域作出的重大贡献.他们的实验和理论能共同协力探讨分子体系的性质.下列说法正确的是
A.未来化学的研究方向是经验化 B.化学不需要再做实验
C.化学不再是纯实验学科 D.化学不做实验,就什么都不知道
难度: 简单查看答案及解析
-
东晋炼丹家葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成了丹砂”这句话里没有涉及到的反应类型为( )
A.氧化还原反应 B.化合反应 C.分解反应 D.置换反应
难度: 简单查看答案及解析
-
下列物质能产生丁达尔效应的是
A.淀粉溶液 B.蒸馏水 C.饱和食盐水 D.纯净的空气
难度: 简单查看答案及解析
-
配制一定物质的量浓度的溶液所使用的容量瓶上没有标明的是
A.规格 B.温度 C.刻度线 D.物质的量浓度
难度: 简单查看答案及解析
-
目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.葡萄糖 C.MgSO4 D.CO2
难度: 简单查看答案及解析
-
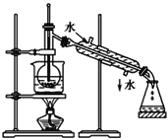
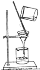
如图所示,下列实验操作与方法正确的是( )
A.检查容量瓶是否漏水的方法
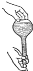
B.滴加液体
C.给溶液加热

D.过滤
难度: 简单查看答案及解析
-
在下列自然资源的开发利用中,不涉及化学变化的是
A.用海水制盐 B.从海水中提取镁
C.从海水中提取溴 D.从海带中提取碘
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.氧气的摩尔质量是32 g B.6.02×1023个N2分子的质量是28 g/mol
C.1 mol H2O的质量是18g D.1 mol CO2中所含氧原子数约是6.02×1023个
难度: 中等查看答案及解析
-
下列电离方程式书写错误的是
A.H2S=2H++S2﹣ B.NH4NO3=NH4++NO3﹣
C.Na2SO4=2Na++SO42﹣ D.Ba(OH)2=Ba2++2OH﹣
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.澄清石灰水与盐酸反应:H++OH-=H2O B.醋酸溶液与Na2CO3溶液:CO32-+2H+=CO2 ↑+H2O
C.镁与稀盐酸反应:Mg+2H++2Cl-=MgCl2+H2↑ D.铝与氢氧化钠溶液:2Al+2OH-=2AlO2-+3H2↑
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol•L﹣1 K2SO4溶液中含有的钾离子数为2NA
B.1mol氯气完全反应生成氯离子得到的电子数为NA
C.22 .4L CO2中含有的分子数为NA
D.1mol Fe与足量的硫单质充分反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ba2+ Na+ NO3- S2- B.Mg2+ Cl- Al3+ SO42-
C.K+ Cl- HCO3- NO3- D.Ca2+ Na+ Fe3+ NO3-
难度: 中等查看答案及解析
-
在一点条件下,RO3n-+F2+aOH-=RO4- +2F-+H2O,下列叙述正确的是( )
A.n=2,a=2 B.n=2,a=1
C.RO3n-中R的化合价为+6 D.n=1,a=2
难度: 中等查看答案及解析
-
二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下化学反应:
①SeO2+4KI+4HNO3→Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O。下列有关叙述不正确的是
A.反应①中每有0.6mol I2生成,转移电子数目为1.2NA
B.①中HNO3仅体现了酸性
C.反应②中Se 是还原剂,SeO2是还原产物
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
难度: 中等查看答案及解析
-
现有钠、镁、铁质量分别为2.3 g、4.8 g、12.0 g,使其分别与100 mL 0.5 mol/L的盐酸充分反应后,所得H2的质量关系正确的是
A.氢气的质量相同 B.铁放出氢气最多
C.钠放出氢气最多,铁最少 D.钠放出的氢气最多,镁铁相同
难度: 中等查看答案及解析
-
m g氢气和n g氦气的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比
>1
D.同温同压下,H2与He的密度比为2∶1
难度: 中等查看答案及解析
-
关于Na2CO3和NaHCO3性质的叙述正确的是( )
A.在水中溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3>NaHCO3
C.将澄清石灰水加入NaHCO3溶液中不产生白色沉淀,而加入Na2CO3溶液中则产生白色沉淀
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
难度: 中等查看答案及解析
-
下列实验装置不能达到实验目的的是( )
A.验证Na和水反应是否为放热反应:
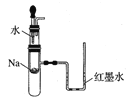
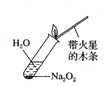
B.检验Na2O2与H2O反应有O2生成:
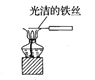
C.观察纯碱的焰色反应:
D.比较Na2CO3、NaHCO3的稳定性:
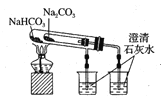
难度: 中等查看答案及解析
-
下列溶液中,Cl-的物质的量浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-的物质的量浓度相等的是
A.150 mL 2 mol·L-1 KCl溶液 B.75 mL 1.5 mol·L-1 MgCl2溶液
C.100 mL 1 mol·L-1 NaCl溶液 D.25 mL 2 mol·L-1 AlCl3溶液
难度: 简单查看答案及解析
-
按照下列操作配出的溶液,物质的量浓度是1mol/L的是
A.将53gNa2CO3溶于水配成500mL溶液 B.将40g氢氧化钠溶于1L水中
C.将1L10mol/L的NaCl溶液溶于9L水中 D.将22.4LHCl溶于水配成1L溶液
难度: 困难查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl﹣
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣
C.加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中一定不含有K+
难度: 中等查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A. 这个反应是氧化还原反应 B. 金刚石属于金属单质
C. 另一种化合物为NaCl D. 制造过程中元素种类没有改变
难度: 简单查看答案及解析
-
今有某两种金属混合物4.5g,将其与足量的稀硫酸反应,能产生2.24L氢气(标准状况),则这两种金属可能是
A.镁和铝 B.铝和钠 C.钠和铜 D.铜和锌
难度: 困难查看答案及解析
-
某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A.Mg2+、Al3+、Na+ B.H+、Mg2+、Al3+ C.H+、Ba2+、Al3+ D.Ba2+、Mg2+、Al3+
难度: 中等查看答案及解析