-
Ⅰ. 某厂废水中含有KCN,其浓度为0.1mol/L ,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):KCN+2KOH+Cl2=KOCN+2KCl +H2O
(1)上述反应中被氧化的元素是__________(用元素符号表示)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式(在答题卡上写出完整配平后的方程式): ____KOCN+____Cl2+____=____K2CO3 +____N2+____ KCl +_______。
(3)若将10L含KCN的浓度为0.01mol/L 的废水中KCN氧化为N2除去,最少需要氯气 ____mol。
Ⅱ. 某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用80mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需_______ ;已知Na2S2O3溶于水会有吸热现象,则配制溶液时未恢复至室温就定容会引起所配溶液浓度_______(填偏高、偏低或无影响)。
(5)Na2S2O3溶液显弱碱性,有较强还原性较强,在溶液中易被Cl2氧化为SO42-,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为__________ 。
高一化学实验题中等难度题查看答案及解析
-
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为0.65g
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
 该反应中,被氧化的元素是___________,氧化产物是_______________。
该反应中,被氧化的元素是___________,氧化产物是_______________。(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目:

(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________g.
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中—种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:_____________(已知:氯元素最高化合价为+7价)
高一化学填空题中等难度题查看答案及解析
-
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目_______________________________:
KOCN+KOH+Cl2→CO2+N2+KCl+H2O
(3)若处理上述废水100L,使KCN完全转化为无毒物质,至少需液氯_______g。
高一化学填空题简单题查看答案及解析
-
(12分)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
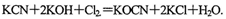 该反应中,被氧化的元素是___________.
该反应中,被氧化的元素是___________.(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目:
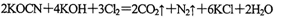
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________g.
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是___________.
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中—种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________.(已知:氯元素最高化合价为+7价)
高一化学填空题困难题查看答案及解析
-
(10分).在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为10 m mol / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O,被氧化的元素是________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯________g。
高一化学计算题简单题查看答案及解析
-
铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O72-)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:_______________________________________。
(2)试配平:____Fe2++_____Cr2O72- +__ ______=______Fe3++______Cr3++______H2O
(3)若该废水中Cr3+的含量为1×10-2mol·m-3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm-3)。
高一化学综合题中等难度题查看答案及解析
-
铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O72-)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式___________________________________。
(2)试配平:_____Fe2++______Cr2O72-+_______H+=_____Fe3++_____Cr3++_____H2O。
(3)若该废水经处理后Cr3+的含量为1×10−2mol·m−3,理论上83.4 kg绿矾可以处理该废水_____吨(已知废水的密度为1 g·cm−3)。
高一化学填空题中等难度题查看答案及解析
-
(6分)某工业废水含有Cu2+、Fe3+、 Al3+、Fe2+、Cl-、NO3-、SO42-、SiO32-中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。为探究废水的组成,甲同学进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)由Ⅰ判断,溶液中一定不含有的阳离子是________(写离子符号);
(2)Ⅱ中生成的无色气体是 ________,生成无色气体的反应中被氧化的离子是________;
(3)甲同学最终确定原溶液中所含阳离子是________,阴离子是________(写离子符号);
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是 ________

高一化学实验题中等难度题查看答案及解析
-
某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是____________________;
(2)第②步中用pH试纸测定溶液pH的操作是:________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________;
(4)欲使1L该废水中Cr2O72-的完全转化为Cr0.5Fe1.5FeO4。理论上需要加入____FeSO4·7H2O。
高一化学实验题困难题查看答案及解析
-
某厂废水中含5.00×10-3mol•L-1的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下

实验流程:
(1)第①步反应的离子方程式是______
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______
(3)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______gFeSO4•7H2O.高一化学解答题中等难度题查看答案及解析