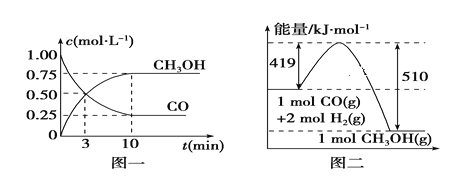
-
化学在生产和日常生活中有着重要应用。下列说法不正确的是( )
A.施肥时,草木灰(有效成份K2CO3)不能与NH4Cl混合使用
B.热的纯碱能去厨房油污是因为其水解呈碱性,可以使油脂水解成水溶性物质
C.FeCl3用于印刷线路板是因为FeCl3水解呈酸性
D.使用含氟牙膏预防龋齿利用了沉淀转化的原理
难度: 简单查看答案及解析
-
下列微粒中,对水的电离平衡不产生影响的是( )
A.Na+ B.HCO3- C.
D.
难度: 简单查看答案及解析
-
用pH试纸测下列溶液的酸碱性,明显不同其他溶液的一种是( )
A.NH4Cl B.CH3COOK C.Al(NO3)3 D.CuSO4
难度: 简单查看答案及解析
-
下列相关方程式或离子方程式正确的是
A.碳酸的电离方程式:H2CO3
2H++CO32-
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3 H2O
Fe(OH)3(胶体)+3 H+
C.泡沫灭火器原理可表示为:2Al3++3CO32-+3 H2O=2Al(OH)3↓+3CO2↑
D.NaClO溶液呈碱性:ClO—+H2O
HClO+OH-
难度: 简单查看答案及解析
-
一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响产生氢气的量,可向其中加入( )
A.CH3COOK固体 B.CuCl2固体 C.KNO3溶液 D.铁粉
难度: 简单查看答案及解析
-
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)
Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
A.v正(X)=2v逆(Y) B.混合气体的压强不再变化
C.混合气体的密度不再变化 D.单位时间内生成lmolY的同时分解2mol X
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) ΔH <0,下列各图中正确的是( )
A.
 B.
B.
C.
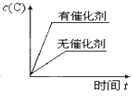 D.
D.
难度: 中等查看答案及解析
-
t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=
。有关该平衡体系的说法正确的是
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述中,正确的是( )
A.对于反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0,升温ΔH不变
B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g) △H = -483.6 kJ/mol,则H2的燃烧热为 241.8 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 ,则△H1>△H2
难度: 简单查看答案及解析
-
下列关于pH变化的判断正确的是( )
A.温度升高,Na2CO3溶液pH减小 B.温度升高,纯水pH增大
C.新制氯水经光照一段时间后,溶液pH减小 D.氢氧化钠溶液久置于空气中,溶液pH变大
难度: 简单查看答案及解析
-
关于溶液的酸碱性说法正确的是( )
A.水电离的 c(H+)=1×10﹣13 mol•L﹣1一定呈碱性 B.pH=7的溶液一定呈中性
C.c(OH﹣)=c(H+)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
难度: 简单查看答案及解析
-
下列不能证明一元酸HA为弱酸的是( )
A.向HA溶液中加少量NaA固体,溶液pH值发生变化
B.pH试纸显示0.1 mol/L HA溶液的pH为3(室温下)
C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强
D.HA溶液能与CH3COONa溶液反应生成CH3COOH
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.100 ℃时,0.1 mol·L-1 HCl和NaOH溶液的pH分别为1和13
B.氯化钾在电流的作用下电离成钾离子和氯离子
C.加热蒸发Na2CO3溶液可获得Na2CO3晶体
D.向10 mL0.1mol/L盐酸和20 mL0.1mol/L的盐酸溶液中分别加入相同质量的镁粉,后者的反应速率更大
难度: 简单查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是( )
A.水电离产生的c(H+)=1×10-12mol·L-1的溶液:Mg2+、SO42-、NO3-、Cl-
B.含有大量Fe3+的溶液:K+、Na+、AlO2-、SO42-
C.能使石蕊试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
D.含有大量S2-的溶液:Na+、Cu2+、Cl―、CO32-
难度: 简单查看答案及解析
-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.升高温度
难度: 简单查看答案及解析
-
在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) B.2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.c(OH-)=c(HCO3-)+c((H2CO3))+c(H+) D.c(HCO3-)>c(H2CO3)
难度: 简单查看答案及解析
-
为了除去CuCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A.NaOH B.Na2CO3 C.Cu(OH)2 D.氨水
难度: 简单查看答案及解析
-
升高温度,下列数据不一定增大的是( )
A.水解平衡常数Kh B.化学平衡常数K
C.化学反应速率v D.水的离子积常数Kw
难度: 中等查看答案及解析
-
25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
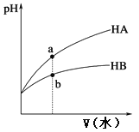
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡CH3COOH
H++CH3COO-,下列叙述不正确的是( )
A.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大
B.0.1 mol·L-1的醋酸溶液,由水电离出来的c(H+)=1.0×10-13 mol·L-1
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
难度: 简单查看答案及解析
-
在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )

A.在t℃时,AgI的Ksp=2.5×10-15mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)
AgI(s)+Br-(aq)的平衡常数K=200
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中
增大
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中所得溶液中c(Cl-)=c(I-)
难度: 简单查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )

A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
难度: 简单查看答案及解析
-
25℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
下列反应不能发生的是( )
A.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.ClO-+CO2+H2O=HCO3-+HClO
D.2ClO-+CO2+H2O=CO32-+2HClO
难度: 简单查看答案及解析
-
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s
0
50
150
250
350
n(PCl3)/mol
0
0.32
0.38
0.40
0.40
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
难度: 简单查看答案及解析