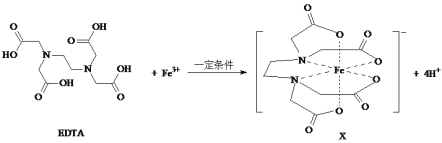
-
下列做法与社会可持续发展理念相符合的是
A.推广一次性塑料袋的使用
B.应用高效洁净的能源转换技术
C.加快化石燃料的开采与使用
D.大量开采地下水以满足工业生产需求
难度: 中等查看答案及解析
-
用化学用语表示2H2S+3O2
2SO2+2H2O中的相关微粒,其中正确的是
A.中子数为18的硫原子:
S
B.H2S的比例模型:
C.H2O的结构式:H-O-H
D.S的结构示意图:
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.MgO熔点很高,可用作耐高温材料
B.Al(OH)3受热易分解,可用于制胃酸中和剂
C.FeCl3溶液显酸性,可用于蚀刻印刷电路
D.NaClO溶液能与CO2反应,可用作漂白剂
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1 Na2SO3溶液:NH4+、K+、ClO−、Cl−
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42-
C.0.1 mol·L-1 HCl溶液:Ba2+、K+、HCO3-、NO3-
D.0.1 mol·L-1 Ba(NO3)2溶液:K+、Na+、SO42-、Cl−
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
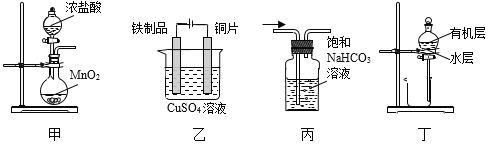
A.用装置甲制取氯气
B.用装置乙在铁制品表面镀铜
C.用装置丙除去CO2中的少量HCl
D.用装置丁分液,放出水层后再从分液漏斗下口放出有机层
难度: 中等查看答案及解析
-
下列有关物质性质的叙述错误的是
A.HNO3受热分解可生成NO2
B.Na在O2中燃烧可生成Na2O2
C.CaCl2暴露在空气中可生成CaCO3
D.向FeCl3溶液中滴加KSCN溶液,溶液显红色
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用KIO3溶液氧化酸性溶液中的KI:5I-+ IO3- + 3H2O = 3I2 + 6OH-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2
C.Cu溶于稀HNO3:Cu + 2H+ + NO3- = Cu2+ + NO2↑+ H2O
D.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次递增,其原子的最外层电子数之和为15。X与Y位于相邻周期,Z是地壳中含量最高的金属元素,W原子最外层电子数是X原子内层电子数的3倍。下列叙述一定正确的是
A.原子半径的大小顺序:r(W) > r(Z) > r(Y) > r(X)
B.X的简单气态氢化物易溶于水
C.Y的最高价氧化物对应的水化物的碱性比Z的强
D.Z的最高价氧化物的水化物能溶于X的最高价氧化物的水化物
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.Al
Al(OH)3
Al2O3
B.Fe2O3
FeCl3(aq)
无水FeCl3
C.NaCl(aq)
Cl2
漂白粉
D.N2
NH3
NO
难度: 中等查看答案及解析
-
下列说法正确的是
A.2NO(g) + 2CO(g) = N2(g) + 2CO2 (g)在常温下可自发进行,则该反应的ΔH>0
B.一定条件下反应2SO2 + O2⇌2SO3(g)达到平衡时,v正(O2)=2v逆(SO3)
C.铁与稀硫酸反应生成22.4 L H2时,转移的电子数约为2×6.02×1023
D.氢氧燃料电池工作时,H2在负极上失去电子
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向蛋白质溶液中滴加饱和CuSO4溶液,有固体析出,再加水固体不溶解
蛋白质的结构已发生变化
B
室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀
Ksp(BaSO4)< Ksp(CaSO4)
C
向久置Na2SO3溶液中,加入足量稀硝酸,再加入足量BaCl2溶液,出现白色沉淀
久置Na2SO3已部分被氧化
D
C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去
证明生成了乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
根据下列图示所得出的结论一定错误的是
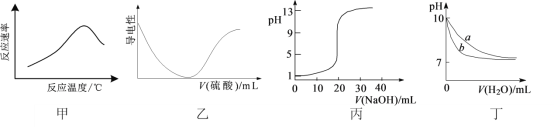
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
难度: 中等查看答案及解析
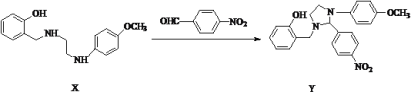

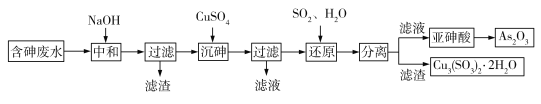
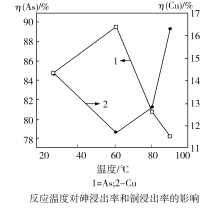
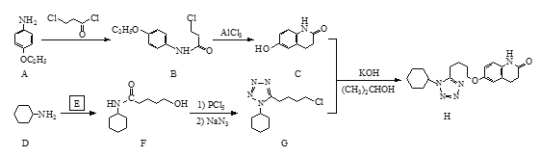
 ;
; 。
。