-
市场上销售的加碘食盐、含氟牙膏中,碘、氟是指
A. 单质 B. 分子 C. 元素 D. 原子
难度: 简单查看答案及解析
-
炒菜时油锅起火,可用锅盖盖灭,其灭火原理是
A. 清除可燃物 B. 隔绝空气
C. 降低油的着火点 D. 防止油溅出
难度: 简单查看答案及解析
-
下列物质放入水中,不能形成溶液的是
A. 食醋 B. 食盐 C. 蔗糖 D. 花生油
难度: 简单查看答案及解析
-
我们身边的下列物质,属于纯净物的是
A. 酱油 B. 蒸馏水 C. 医用酒精 D. 洁净的空气
难度: 简单查看答案及解析
-
汽车尾气是空气污染的元凶之一,使用催化净化装置,可以有效减少尾气污染,其反应原理之一是2NO+2CO=N2+2X.下列说法不正确的是( )
A. X的化学式为CO2
B. 该反应前后元素种类不变
C. 反应前后氮元素的化合价不变
D. 汽车尾气中的一氧化碳主要来源于汽油的不充分燃烧
难度: 简单查看答案及解析
-
铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的
A.导电性 B.延展性 C.导热性 D.抗腐蚀性
难度: 简单查看答案及解析
-
“绿水青山就是金山银山”,垃圾分类处理有利于生态文明建设。废弃物中,易拉罐属于
A. 可回收物 B. 餐厨垃圾 C. 有害垃圾 D. 其它垃圾
难度: 简单查看答案及解析
-
下列变化属于化学变化的是
A.盐酸挥发 B.牛奶发酵 C.海水晒盐 D.干冰升华
难度: 简单查看答案及解析
-
下列物质的用途中,利用其物理性质的是
A.硫酸用于除铁锈
B.生石灰用作食品干燥剂
C.大理石用作建筑材料
D.氮气用作保护气
难度: 简单查看答案及解析
-
地壳中含量最多的金属元素是
A. 氧 B. 硅 C. 铝 D. 铁
难度: 简单查看答案及解析
-
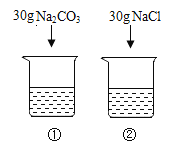
碳酸钠是重要的化工原料,其俗称是
A.火碱 B.食盐 C.纯碱 D.小苏打
难度: 简单查看答案及解析
-
下列关于物质用途的描述中,不正确的是
A.氧气用于气焊 B.二氧化碳作燃料
C.浓硫酸作干燥剂 D.熟石灰用于改良酸性土壤
难度: 简单查看答案及解析
-
下列元素中,人体摄入量过低会引起贫血的是
A. Fe B. Zn C. Na D. Ca
难度: 简单查看答案及解析
-
符号 2N、N2、2CO、CO2,数字“2”能用来表示分子个数的是
A.2N
B.N2
C.2CO
D.CO2
难度: 简单查看答案及解析
-
将空的矿泉水瓶从高原地区带到平原,瓶子变瘪,瓶内气体
A.分子体积变小
B.分子质量变小
C.分子数目减少
D.分子间隔变小
难度: 简单查看答案及解析
-
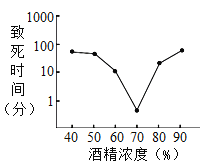
在四个小烧杯中分别盛放下列物质,在空气中放置一段时间后,质量会增加的是
A.浓硫酸 B.浓盐酸 C.汽水 D.饱和食盐水
难度: 简单查看答案及解析
-
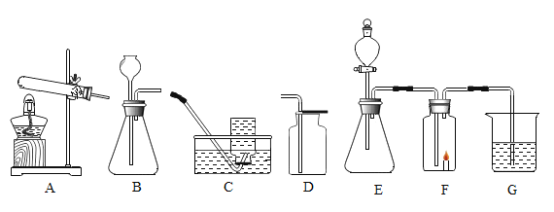
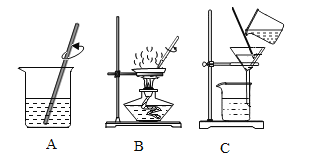
下列实验操作正确的是
A.
滴加液体 B.
 取用固体粉末
取用固体粉末C.
 加热液体 D.
加热液体 D.  熄灭酒精灯
熄灭酒精灯难度: 简单查看答案及解析
-
我国的稀土储量居世界第一位。铕(Eu)是一种稀土元素,下列有关说法中错误的是()
A.铕属于非金属元素 B.铕的原子序数是63
C.铕原子中的质子数为63 D.铕的相对原子质量是152.0
难度: 简单查看答案及解析
-
下列不属于化石燃料的是
A.氢能
B.煤
C.石油
D.天然气
难度: 简单查看答案及解析
-
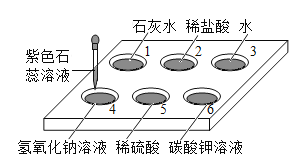
向下列物质中加入稀盐酸,无明显现象的是( )
A.NaHCO3溶液 B.滴有酚酞的NaOH溶液
C.Fe2O3粉末 D.NaCl溶液
难度: 简单查看答案及解析
-
下列化学式能正确表示物质组成的是
A. 氢氧化镁—MgOH B. 高锰酸钾—KmnO4
C. 氧化铁—Fe2O3 D. 碳酸钠—NaCO3
难度: 简单查看答案及解析
-
硝酸铜[Cu(NO3)2]受热分解会产生一种污染空气的有毒气体,该气体可能是
A.NO2
B.N2
C.O2
D.SO2
难度: 简单查看答案及解析
-
夏天从冰箱里拿出一瓶饮料,放在空气中,外壁会潮湿,这说明空气中含有( )
A.稀有气体 B.水蒸气 C.二氧化碳 D.二氧化硫
难度: 简单查看答案及解析
-
农业上常用质量分数为16%的NaCl溶液选种。实验室配制100 g该浓度溶液的过程如下图所示。下列说法不正确的是

A. 实验操作顺序为④②①⑤③ B. ②中需称量NaCl的质量为16 g
C. 选用100 mL量筒量取所需水的体积 D. ①中有部分固体洒落所得溶液的浓度偏大
难度: 中等查看答案及解析
-
枯茗醛(化学式为 C10H12O)是一种食用香料,下列说法正确的是
A.枯茗醛属于氧化物
B.枯茗醛属于混合物
C.一个枯茗醛分子中含有 23 个原子
D.枯茗醛中碳元素和氢元素的质量比为 5:6
难度: 简单查看答案及解析
-
一氧化二氮和一氧化碳是环境污染性气体,可在催化剂表面转化为无害气体。该反应前后分子种类变化的微观示意图如下。下列说法正确的是
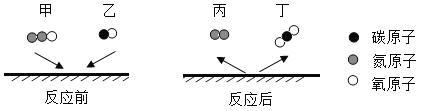
A.反应前后元素的种类发生改变
B.该反应为置换反应
C.两种生成物均是化合物
D.生成的丙与丁的质量比为 7:11
难度: 中等查看答案及解析
-
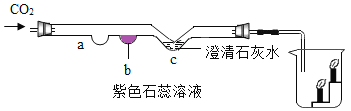
实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如下图所示。下列说法不正确的是
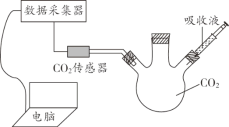
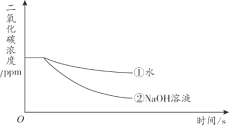
A. 曲线①是CO2溶解和CO2与水反应的综合结果
B. 对比曲线①和②,可说明CO2能与NaOH反应
C. NaOH溶液吸收CO2的效果比水好
D. 若选用等量饱和石灰水进行实验,其曲线在①上方
难度: 简单查看答案及解析