-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
现象或事实
解释
A
Al(OH)3用作塑料的阻燃剂
Al(OH)3受热熔化放出大量的热
B
K2FeO4用于自来水的消毒和净化
K2FeO4具有强氧化性,被还原后生成的Fe3+水解生成胶状物,可以软化硬水
C
Na2O2用于呼吸面具中作为O2的来源
Na2O2是强氧化剂,能氧化CO2生成O2
D
浸泡过KMnO4溶液的硅藻土可用于水果保鲜
KMnO4溶液可氧化水果释放的CH2=CH2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
用下列装置完成相关实验,合理的是( )
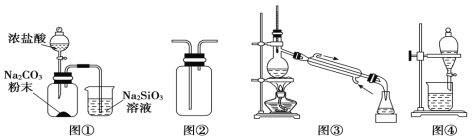
A. 图①:验证H2CO3的酸性强于H2SiO3
B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5
D. 图④:分离CH3CH2OH与CH3COOC2H5
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键又含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应
难度: 困难查看答案及解析
-
化学式为C3H7FO的物质,含有羟基的同分异构体数目为(不考虑空间异构)( )
A. 4种 B. 5种 C. 6种 D. 7种
难度: 困难查看答案及解析
-
银Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与Ferrozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是( )
A. ①中,负极上消耗1 mol甲醛时转移2 mol电子
B. ①溶液中的H+由正极移向负极
C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1∶4
D. ④中,甲醛浓度越大,吸光度越小
难度: 困难查看答案及解析
-
常温下,向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是( )
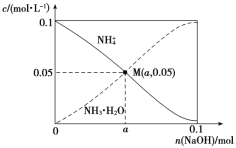
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
C. 随着NaOH的加入,c(H+)/c(NH4+)不断增大
D. 当n(NaOH)=0.1 mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
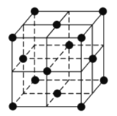
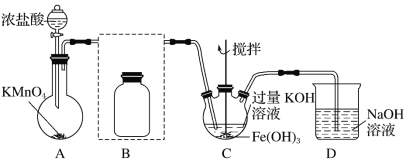
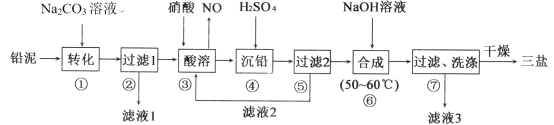
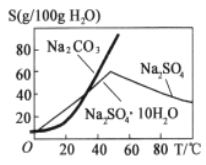
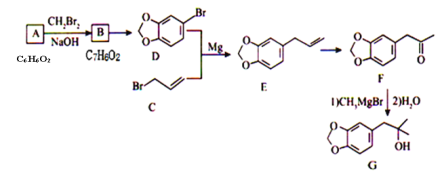
 的合成路线________。
的合成路线________。