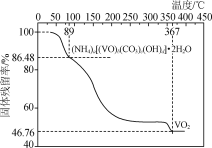
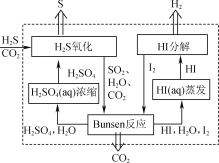
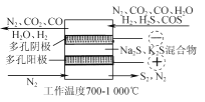
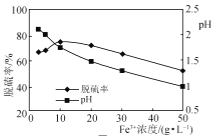
-
研究表明,雾霾中的无机颗粒主要是硫酸铵和硝酸铵,大气中的氨是雾霾的促进剂。减少氨排放的下列解决方案不可行的是( )
A. 改变自然界氮循环途径,使其不产生氨 B. 加强对含氨废水的处理,降低氨气排放
C. 采用氨法对烟气脱硝时,设置除氨设备 D. 增加使用生物有机肥料,减少使用化肥
难度: 中等查看答案及解析
-
用ClCH2CH2OH和NaCN为原料可合成丙烯酸,相关化学用语表示错误的是( )
A. 质子数和中子数相等的钠原子:2211Na
B. 氯原子的结构示意图:
C. NaCN的电子式:

D. 丙烯酸的结构简式:CH3CH=CHCOOH
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. FeCl3易发生水解,可用于蚀刻铜制的印制线路板
B. 漂白粉具有氧化性,可用于脱除烟气中SO2和NO
C. CaCO3高温下能分解,可用于修复被酸雨侵蚀的土壤
D. 活性炭具有还原性,可用于除去水体中Pb2+等重金属
难度: 中等查看答案及解析
-
CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A.
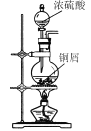 制备SO2
制备SO2B.
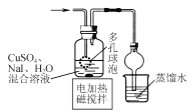 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液C.
 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀D.
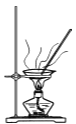 加热干燥湿的CuI固体
加热干燥湿的CuI固体难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B. 0.1 mol/LNaClO溶液:K+、Fe2+、Cl-、SO42-
C. 0.1mol/L氨水:K+、Ag(NH3)2+、NO3-、OH-
D. 由水电离产生的c(H+)=1×10-13 mol/L的溶液:Na+、NH4+、Cl-、HCO3-
难度: 中等查看答案及解析
-
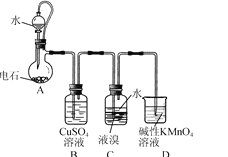
下列指定反应的离子方程式正确的是( )
A. Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-=CaSO4↓
B. Cl2与热的NaOH溶液反应:Cl2+6OH-
Cl-+ClO3-+3H2O
C. 电解K2MnO4碱性溶液制KMnO4:2MnO42-+2H+
2MnO4-+H2↑
D. NaHCO3与过量Ba(OH)2溶液反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大。 X的族序数是周期数的3倍,25 ℃时,0.1 mol·L-1Z的最高价氧化物对应的水化物溶液的pH为13,W的最外层有6个电子。下列说法正确的是( )
A. X的简单气态氢化物的热稳定性比W的弱
B. 原子半径:r(Z)>r(W)>r(X)>r(Y)
C. 元素Y、W的简单阴离子具有相同的电子层结构
D. Z分别与X、Y、W形成的化合物中均一定只含离子键
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu2S(s)
Cu(s)
CuCl2(s)
B. SiO2(s)
H2SiO3(s)
Na2SiO3(aq)
C. Fe(s)
Fe2O3(s)
Fe2(SO4)3(aq)
D. NaCl(aq)
Na2CO3(s)
NaOH(aq)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 粗铜电解精炼时,粗铜、纯铜依次分别作阴极、阳极
B. 5.6 g Fe在足量Cl2中充分燃烧,转移电子的数目为0.2×6.02×1023
C. 室温下,稀释0.1 mol/L NH4Cl溶液,溶液中
增大
D. 向BaCO3、BaSO4的饱和溶液中加入少量BaCl2,溶液中
减小
难度: 中等查看答案及解析
-
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
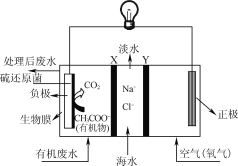
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
难度: 中等查看答案及解析
-
化合物X(5没食子酰基奎宁酸)具有抗氧化性和抗利什曼虫活性而备受关注,X的结构简式如图所示。下列有关X的说法正确的是 ( )
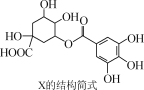
A. 分子式为C14H15O10
B. 分子中有四个手性碳原子
C. 1 mol X最多可与4 mol NaOH反应
D. 1 mol X最多可与4 mol NaHCO3反应
难度: 中等查看答案及解析
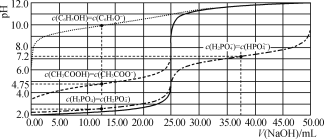
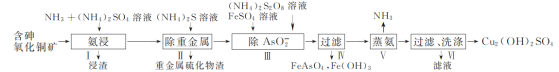
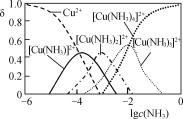

 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。