-
四溴乙烷(CHBr2-CHBr2)是一种无色透明液体,密度2.967 g/mL,难溶于水,沸点244 ℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3As2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图所示。
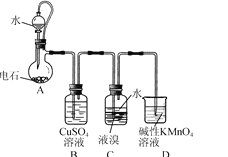
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+HC≡CH↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的措施是________。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为________(生成铜、硫酸和磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是________;装置C中反应已完成的现象是________;从装置C反应后的体系得到并纯化产品,需要进行的操作有________。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25 L含0.5 mol/LCa(OH)2的石灰乳,________,在100 ℃烘箱中烘干1 h。
已知:
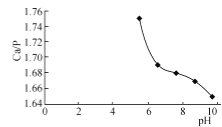
① Ca10(PO4)6(OH)2中 比理论值为1.67。影响产品
比理论值为1.67。影响产品 比的主要因素有反应物投料比及反应液pH。
比的主要因素有反应物投料比及反应液pH。
②在95 ℃,pH对 比的影响如图所示。
比的影响如图所示。
③实验中须使用的试剂:含0.5mol/LCa(OH)2的石灰乳、0.3mol/L磷酸及蒸馏水。
-
(12分)l,2二溴乙烷可作汽油抗爆剂的添加剂,常温 下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
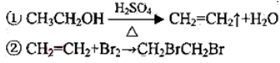
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
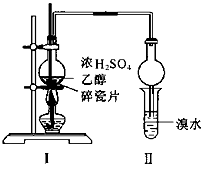
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:
_________________________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理
由是________(填正确答案的标号,下同)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.使溴水褪色的反应,未必是加成反应
D.浓硫酸氧化乙醇生成的乙醛,也会使溴水褪色
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为________,其作用是________B中的试剂为________,其作用是________。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________,该仪器在使用前须清洗干净并_________。
-
1,2—二溴乙烷是一种无色液体,有挥发性,有毒,难溶于水,沸点为132℃,密度为2.2g•mL-1。某研究性学习小组的同学利用如图(加热装置省略)装置制备一定量的1,2—二溴乙烷,制备原理为:C2H5OH→C2H4→CH2BrCH2Br。Y中的浓硫酸是催化剂、脱水剂,乙醇的密度为0.8g•mL-1。
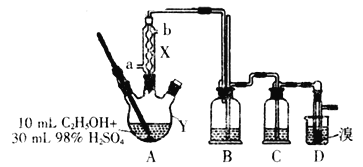
(1)仪器Y的名称是__,由乙醇制备乙烯需要控制温度在170℃,使用X的目的是__,实验中加热A与向X中通入冷却剂的顺序是__。
(2)实验时Y中液体会变成黑色,并有刺激性气味的无机气体产生,变成黑色的原因是__,为吸收反应中生成的无机气体,在装置C中应加入__。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)写出D中反应的化学方程式:__;若产物中有少量未反应的Br2,最好用___洗涤除去。
a.水 b.Na2CO3溶液 c.碘化钠溶液 d.乙醇
(4)该套装置存在一个明显的不足,不足之处是__。
(5)若得到ag1,2—二溴乙烷,所用乙醇的利用率为__。
-
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·㎝-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示制备1,2-二溴乙烷。其中分液漏斗和烧瓶a 中装有乙醇和浓H2SO4的混合液,试管d 中装有液溴(表面覆盖少量水)。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式 , 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d 是否发生堵塞。请写出发生堵塞时瓶b 中的现象 。
(3)容器c 中NaOH溶液的作用是 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓H2SO4混合液的量,比正常情况超过许多。如果装置的气密性没有问题,试分析其可能的原因_______________。
-
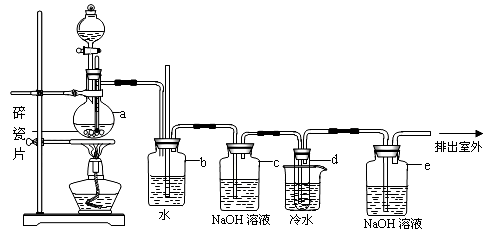
实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如下图,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm,3沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。请回答以下问题:
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入 。
烧瓶内发生的反应的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中盛有10%的NaOH溶液,其作用是 。
(4)装置D中试管中装有液溴,实验开始后观察到的主要现象是 。
(5)开始反应时需向装置D中的烧杯里加入冰水,这是为了 。
(6)装置E的作用 。
-
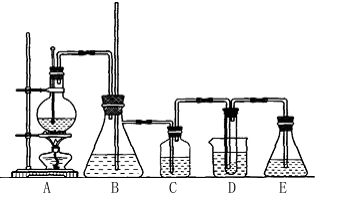
(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
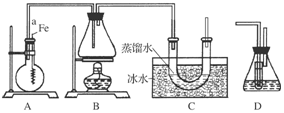
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。
-
汽油抗爆剂的添加剂通常使用1,2-二溴乙烷,常温下它是无色液体,密度2.18 g.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
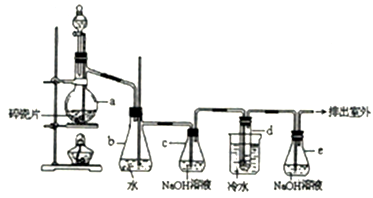
(1)装置a中碎瓷片的作用是__________________________。
(2)安全瓶b可以防止倒吸,并可以检査实验进行时试管d是否发生堵塞,请写出发生堵塞时瓶b中的现象______________________。
(3)判断该制备反应己经结束的最简单的方法是________________________________。
(4)写出装置e中发生的反应的离子方程式_______________________________。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 _____________层(填“上”、“下”),若产物中有少量未反应的Br2,最好用_______________洗涤除去(填正确选项前的字母)。
a.水 b.亚硫酸钠溶液 c.碘化钠溶液 d.乙醇
(6)实验结束时若制得纯净的1,2-二溴乙烷18.8g,则至少消耗乙醇_______________g。
(7)某学生在做此实验时使用了一定量的液溴,当反应结束时,发现消耗乙醇的量比正常情况下超过许多。原因除了装置的气密性不好之外,还有可能的2个原因_______________、_______________。
-
1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。请填写下列空白:
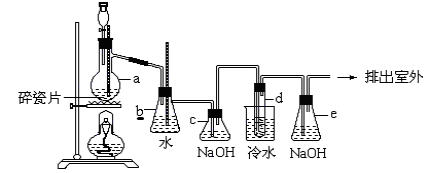
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:____________。
(2)写出制备1,2二溴乙烷的化学方程式: 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象: 。
(4)容器c中NaOH溶液的作用是: 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因:___________。
(6)e装置内NaOH溶液的作用是 。
-
(9分)1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2- 二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
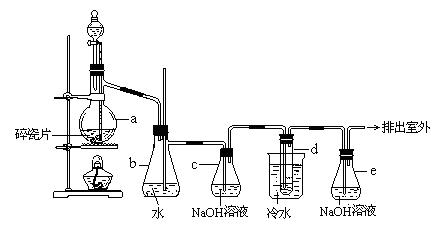
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。
____________________________________________________________
____________________________________________________________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象。
_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因是:
____________________________________________________________
-
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水) 。
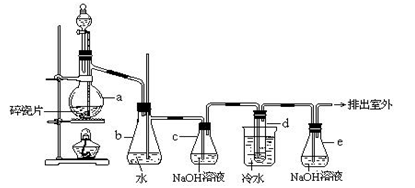
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:
__________________________________________________________,
___________________________________________________________。
(2)配制乙醇和浓硫酸混合液的要求和操作要点________
。
(3)反应后期a中反应物混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因__________________________________________________________________。
(4)瓶b的作用为: ___________________________________________。
(5)容器c、e中NaOH溶液的作用分别是: ______________________
___________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________。

比理论值为1.67。影响产品
比的主要因素有反应物投料比及反应液pH。
比的影响如图所示。











