-
化学科学与技术在宇宙探索、改进生活、改善环境与促进发展方面均发挥着关键性的作用。正确的是
A. “玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
B. “乙醇汽油”、肼(N2H4)和水煤气的主要成分都是可再生能源
C. “神舟”和“天宮”系列飞船使用的碳纤维材料、光导纤维都是新型无机非金属材料
D. 所有糖类、油脂和蛋白质等营养物质在人体吸收后都能被水解利用
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 0.2mol FeI2与足量氯气反应时转移电子数为0.4NA
B. 常温常压下,46g NO2和N2O4混合气体含有的原子数为3NA
C. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
D. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 中等查看答案及解析
-
以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是
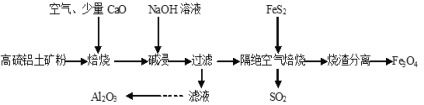
A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
难度: 困难查看答案及解析
-
煤的干馏实验装置如图所示。下列说法错误的是
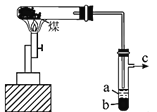
A. 可用蓝色石蕊试纸检验a层液体中含有的NH3
B. 长导管的作用是导气和冷凝
C. 从b层液体中分离出苯的操作是分馏
D. c口导出的气体可使新制氯水褪色
难度: 中等查看答案及解析
-
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
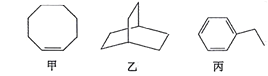
A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Y同主族,R的最外层电子数是次外层电子数的2倍。W元素形成的一种单质可用于自来水的杀菌消毒。R与W元素原子的最外层电子数之和等于X与Z元素原子的最外层电子数之和。下列说法正确的是
A. 简单离子的半径:W<Y<Z
B. X与Z形成的化合物溶于水可抑制水的电离
C. 氧化物对应水化物的酸性:Z>R>X
D. 最高价氧化物的熔点:Y>R
难度: 中等查看答案及解析
-
下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )
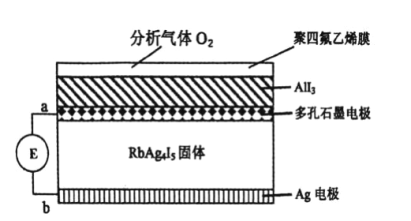
A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
难度: 困难查看答案及解析
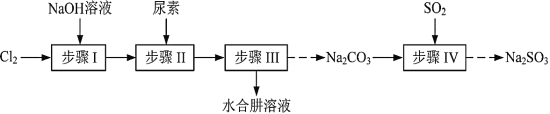

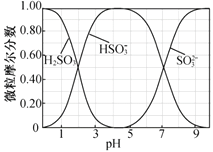
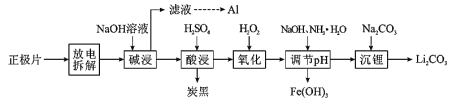
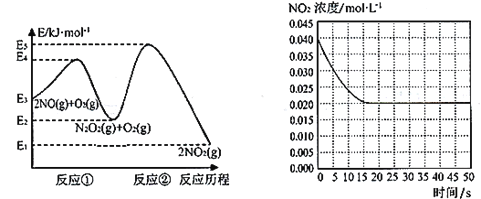
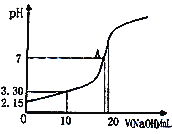
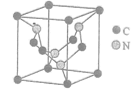
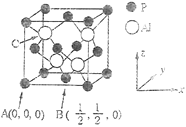

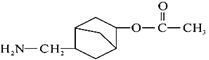 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____