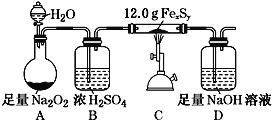
-
关于下列诗句或谚语,说法不正确的是( )
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C.“滴水石穿、绳锯木断”不包含化学变化
D.“落汤螃蟹着红袍”肯定发生了化学变化
难度: 简单查看答案及解析
-
下列化学用语表述正确的是( )
A. 核内质子数为117、中子数为174的核素Ts可表示为:
B. 氯离子的结构示意图:
C. COCl2的结构式为:
D. CaO2的电子式为:
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是
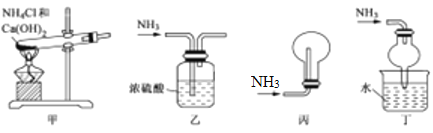
A. 用装置甲制备氨气 B. 用装置乙除去氨气中少量水
C. 用装置丙收集氨气 D. 用装置丁吸收多余的氨气
难度: 简单查看答案及解析
-
一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球B中装的是O2 B. 气球A和气球D中气体物质的量之比为4:1
C. 气球A和气球C中气体分子数相等 D. 气球C和气球D中气体密度之比为2:1
难度: 中等查看答案及解析
-
用硫酸铜晶体配制 480mL 浓度为 0.5mol/L的溶液,下列说法正确的是( )
A.用托盘天平称量60.0g硫酸铜晶体
B.如果称量时药品和砝码放反了,对配制结果没有影响,因为没有使用游码
C.如果定容时俯视所配溶液浓度会偏高
D.在转移溶液后,可以不用洗涤玻璃棒
难度: 中等查看答案及解析
-
为检验某种钠盐溶液中含有的阴离子是SO42-、CO32-还是OH-、Cl-,下面设计的方案中合理的是( )
A. 检验CO32-:向待测液中加入足量的盐酸产生气泡,将气体通入浓Ba(OH)2溶液有白色沉淀生成
B. 检验SO42-:向待测液中加入盐酸至酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀
C. 检验OH-:向待测液中加入石蕊溶液,溶液变红色
D. 检验Cl-:向待测液中加入AgNO3溶液和稀盐酸的混合液,有白色浑浊物出现
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
①22gT2O含有电子数为10NA
②0.44gC3H8中含有的共价键总数目为0.1NA
③1molNa2O2与CO2完全反应时转移电子数为2NA
④28g硅晶体中含有2NA个Si—Si键
⑤11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数等于0.5NA
⑥200mL1mol·L-1Al2(SO4)3溶液中Al3+和SO42-的数目总和是NA
A.①②③ B.②④⑥ C.①③⑤ D.①②④
难度: 中等查看答案及解析
-
硅及其化合物是带来人类文明的重要物质。下列说法正确的是
A.陶瓷、水晶、水泥、玻璃都属于硅酸盐
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示
D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O =Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O =2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
难度: 中等查看答案及解析
-
在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )
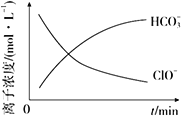
A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
难度: 困难查看答案及解析
-
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到7.84 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
难度: 中等查看答案及解析
-
某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子
CO
、SiO32-、[Al(OH)4]-、Cl-
阳离子
Al3+、Fe3+、Mg2+、NH4+、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
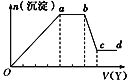
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是
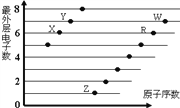
A. 元素的非金属性: X>R>W
B. 简单离子的半径:W>R>X
C. X与W形成的化合物中只有共价键
D. X与Z形成的化合物中只有离子键
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是
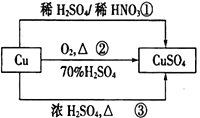
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
难度: 中等查看答案及解析
-
某同学设计了用氯气制取无水氯化铁(易升华)的相关装置,其中设计正确且能达到相应目的的是( )
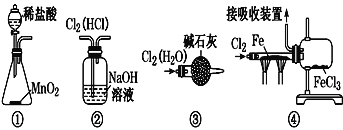
A.用装置①制取氯气
B.用装置②除去Cl2中的HCl
C.用装置③干燥氯气
D.用装置④制取并收集FeCl3
难度: 简单查看答案及解析
-
铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为
A. FeO·3Fe2O3 B. FeO·2Fe2O3 C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
难度: 简单查看答案及解析
-
探究浓硫酸和铜的反应,下列装置或操作正确的是
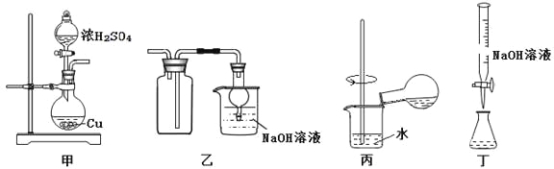
A. 用装置甲进行铜和浓硫酸的反应
B. 用装置乙收集二氧化硫并吸收尾气
C. 用装置丙稀释反应后的混合液
D. 用装置丁测定余酸的浓度
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是
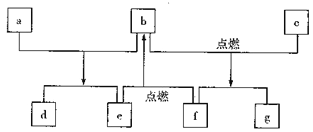
A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y 两种元素组成的化合物只含离子键
难度: 困难查看答案及解析