-
下列属于酸的是
A.SO2 B.CaCO3 C.HClO D.NaOH
难度: 简单查看答案及解析
-
下列属于电解质的是
A.氯气 B.氯化钠 C.蔗糖 D.水玻璃
难度: 简单查看答案及解析
-
下列图示与操作名称不对应的是
A. 升华
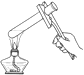 B. 分液
B. 分液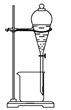
C. 过滤
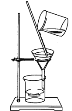 D. 蒸馏
D. 蒸馏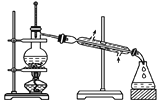
难度: 中等查看答案及解析
-
可用于治疗胃酸过多的物质是
A.氢氧化钠 B.碳酸氢钠 C.氯化铁 D.氯化钠
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.硫酸铜溶液 B.氯化镁溶液 C.碘酒 D.氢氧化铁胶体
难度: 简单查看答案及解析
-
下列类型的反应一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
难度: 简单查看答案及解析
-
下列气体排入大气,能形成酸雨的是
A.CO2 B.N2 C.NO2 D.O3
难度: 简单查看答案及解析
-
下列变化过程中,加入氧化剂才能实现的是( )
A.SO2→SO32- B.CuO→Cu C.Cl2→Clˉ D.Iˉ→I2
难度: 简单查看答案及解析
-
在含有溴化钾和碘化钾的混合溶液里通入过量氯气,然后把此溶液蒸干、灼烧,得到的固体物质是
A.KCl和KBr B.KCl C.I2 D.Br2
难度: 简单查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A.H2O与D2O互称同素异形体 B.1H与D互称同位素
C.氘(D)原子核外有1个电子 D.1H2与D2的化学性质几乎相同
难度: 简单查看答案及解析
-
向MgSO4和A12(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表 示上述反应的是(横坐标表示加入NaOH的体积,纵坐标表示生成沉淀的质量)
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法不正确的是
A.氯水保存在棕色细口瓶中
B.稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢注入水中,并不断搅拌
C.金属钠着火时,可以迅速用水或沙子来灭火
D.实验后剩余的金属钠粒可放回原试剂瓶中
难度: 简单查看答案及解析
-
下列有关硫及其化合物性质的说法中,正确的是
A.铜粉和硫粉混合加热可制得CuS
B.久置酸雨酸性增强,原因是水的挥发
C.SO2通入石蕊试液中,溶液颜色先变红,再褪色
D.亚硫酸钠暴露在空气中容易被氧化成硫酸钠
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列说法正确的是
A.23gNa与足量H2O完全反应生成的H2所含原子数目为NA
B.16g甲烷(CH4)所含的电子数为8NA
C.标准状况下,22.4L水所含分子数为NA
D.足量的Fe在11.2L氯气中完全燃烧,转移电子数为NA
难度: 简单查看答案及解析
-
下列有关Na2CO3和NaHCO3性质的说法中,不正确的是
A.Na2CO3和NaHCO3的俗称分别为纯碱、小苏打
B.相同温度下,在水中的溶解度:Na2CO3>NaHCO3
C.等质量的Na2CO3和NaHCO3分别与过量的盐酸反应,Na2CO3产生CO2的量多
D.等物质的量的Na2CO3和NaHCO3分别与过量的盐酸反应,产生CO2的量一样多
难度: 简单查看答案及解析
-
除去下列物质中所含的少量杂质(括号内为杂质),所用除杂试剂正确的是
A.NaCl溶液(I2)用CCl4 B.硝酸银溶液(硝酸铜)加铜粉
C.Na2CO3(NaHCO3)用HCl溶液 D.CO2(HCl)用NaOH溶液
难度: 简单查看答案及解析
-
下列有关工业生产的说法中不正确的是
A.电解熔融氯化镁可制取金属镁
B.电解饱和食盐水可制取氯气
C.生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D.工业上制取硝酸的第一步为氨的催化氧化反应
难度: 简单查看答案及解析
-
在酸性溶液中能大量共存的离子组是
A.Ca2+、Na+、CO32-、SO42- B.K+、Fe2+、Na+、NO3-
C.HCO3-、K+、Cl-、SO42- D.Na+、Mg2+、Cl-、NO3-
难度: 简单查看答案及解析
-
只用一种试剂把MgSO4、AlCl3、NH4Cl、CuCl2、NaCl五种溶液区别开,这种试剂是
A.NaOH溶液 B.BaCl2溶液 C.AgNO3溶液 D.氨水
难度: 中等查看答案及解析
-
下列离子方程式中,不正确的是
A.过量CO2气体通入NaOH溶液中:CO2+OH-=HCO3-
B.将氯气通入水中:Cl2+H2O
Cl-+ClO-+2H+
C.向SiO2粉末中加入足量的NaOH溶液:SiO2+2OH-= SiO32-+ H2O
D.用氯化铁溶液腐蚀铜,制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
难度: 简单查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子
Cl-
SO42-
H+
M
浓度 /(mol·L-1)
2
1
2
1
A.Na+ B.Al3+ C.NO3- D.Mg2+
难度: 中等查看答案及解析
-
将SO2通入BaCl2溶液中,无明显现象,再加入试剂Y,产生白色沉淀,则Y不可能是
A.NaOH溶液 B.H2O2溶液 C.AgNO3溶液 D.NH4Cl溶液
难度: 简单查看答案及解析
-
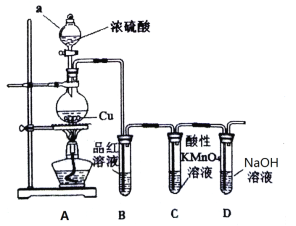
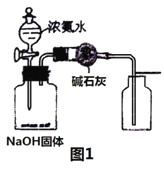
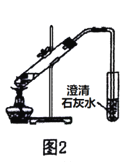
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.用图1所示装置制取并收集少量纯净的氨气
B.用图2所示装置验证木炭与浓硫酸的反应产物中含有CO2
C.用图3所示装置加热分解NaHCO3固体
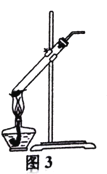
D.用图4所示装置比较KMnO4、Cl2、Br2的氧化性强弱
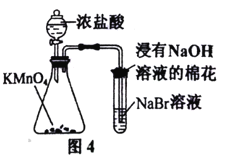
难度: 简单查看答案及解析
-
取铜镁合金14.4g完全溶于一定浓度的硝酸中,反应过程中硝酸的还原产物只有2.24LNO2和4.48LNO气体(气体体积都已折算成标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀的质量为
A.22.4g B.26.3g C.28.5g D.30.0g
难度: 困难查看答案及解析