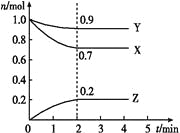
-
下列关于化学反应的速率和限度的说法错误的是( )
A. 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示
B. 影响化学反应速率的条件只有温度和催化剂
C. 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态
D. 催化剂只能加快化学反应速率,不能提高原料利用率和转化率
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A. 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B. c(H+)等于1×10-7mol/L的溶液一定是中性溶液
C. 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D. 任何浓度的溶液都可以用pH来表示其酸性的强弱
难度: 简单查看答案及解析
-
下列变化中属于化学变化且吸热的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A. ②④ B. ①② C. ③⑤ D. ①⑥
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是:
;
难度: 中等查看答案及解析
-
关于原电池、电解池的电极名称,下列说法错误的是
A. 原电池中失去电子的一极为负极
B. 电解池中与直流电源负极相连的一极为阴极
C. 原电池中相对活泼的一极为正极
D. 电解池中发生氧化反应的一极为阳极
难度: 简单查看答案及解析
-
下列关于催化剂的说法正确的是
A.使用催化剂可以增大正反应速率,减小逆反应速率
B.使用催化剂可以使化学平衡向正反应方向移动
C.使用催化剂可以降低反应的活化能
D.使用催化剂可以改变反应的平衡常数
难度: 中等查看答案及解析
-
下列四支试管中,在不同条件下反应:Fe + 2HCl = FeCl2+ H2↑ 判断产生H2的反应速率最快的是
试管
盐酸浓度
温度
铁的状态
A
0.5 mol/L
20℃
块状
B
0.5 mol/L
20℃
粉末状
C
1 mol/L
35℃
块状
D
2 mol/L
35℃
粉末状
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在反应C(s)+CO2(g)
2CO(g)中,可使反应速率明显加快的措施是( )
①升高温度或增大压强 ②增加碳的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2
A. ①③ B. ②④ C. ①④ D. ③⑤
难度: 简单查看答案及解析
-
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
编号
纯锌粉质量
0.2mol•L﹣1硫酸体积
温度
硫酸铜固体质量
Ⅰ
2.0g
10.0mL
25℃
0
Ⅱ
2.0g
10.0mL
t℃
0
Ⅲ
2.0g
10.0mL
35℃
0.2g
Ⅳ
2.0g
10.0mL
35℃
4.0g
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ >Ⅱ >Ⅰ >Ⅳ
难度: 中等查看答案及解析
-
恒温恒压下,对于反应:A(g)+3B(g)
3C(g),达到平衡状态的标志是( )
A.v正(A)=3v逆(C)
B.密闭容器内气体的密度不再改变
C.单位时间内消耗3nmolC的同时,生成3n molB
D.密闭容器内A、B、C气体的浓度之比为1:3:2
难度: 中等查看答案及解析
-
已知汽车尾气无害化处理反应为
。
下列说法不正确的是 ( )
A.升高温度可使该反应的逆反应速率降低 B.使用高效催化剂可有效提高正反应速率 C.反应达到平衡后,N0的反应速率保持恒定 D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.对CO(g)+NO2(g)⇋CO2(g)+NO(g)平衡体系增大压强可使颜色变深
B.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.氯气在水中的溶解度大于在饱和食盐水中的溶解度
D.溴水中有如下平衡:Br2+H2O⇋HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.需加热才能发生的反应一定是△H>0
B.CaCO3(s)受热分解为CaO(s)和CO2(g)反应的△S<0
C.1 mol H2SO4与1 mol Ba(OH)2反应放出的热就是中和热
D.热化学方程式中的化学计量数表示物质的量,所以可以是分数
难度: 简单查看答案及解析
-
下列电离方程式中正确的是( )
A.H2SO4═H2++SO42- B.Ca(OH)2═Ca2++(OH)2
C.AlCl3═Al+3+3Cl- D.Al2(SO4)3═2Al3++3SO42-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 纯水导电性很差,所以水不是电解质
B. 判断某化合物是否为电解质,应看其在一定条件下能否电离
C. 酸、碱和盐类都属于电解质,其他化合物都不是电解质
D. NaCl和HCl都是电解质,所以它们熔融状态下都能导电
难度: 简单查看答案及解析
-
已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离常数约为1×10-7
D.稀释HA溶液时,不是所有粒子浓度都一定会减小
难度: 简单查看答案及解析
-
下列说法正确的是
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
难度: 中等查看答案及解析
-
下列水解离子方程式正确的是
A.Na2CO3∶CO32-+2H2O
H2CO3+2OH-
B.NH4Cl∶NH4++H2O
NH3·H2O+OH-
C.NaF∶F-+H2O===HF+OH-
D.CuSO4∶Cu2++2H2O
Cu(OH)2+2H+
难度: 简单查看答案及解析
-
用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A.滴定前酸式滴定管需用盐酸标准液润洗
B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
难度: 中等查看答案及解析
-
下列说法不正确的是 ( )
A.使用滴定管时,滴定管必须用待装液润洗2~3次
B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌
难度: 中等查看答案及解析