-
下列措施能明显增大原反应的化学反应速率的是
A. Na与水反应时增大水的用量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温、恒容条件下,在工业合成氨反应中,增加氮气的量
难度: 中等查看答案及解析
-
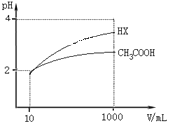
常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向右移动,c(H+)减小
B.加入少量CH3COONa固体,平衡向右移动
C.加入水时,平衡向右移动,CH3COOH电离常数增大
D.加入少量pH=5的硫酸,溶液中c(H+)增大
难度: 中等查看答案及解析
-
下列关于电离常数的说法正确的是( )
A.电离常数随着弱电解质浓度的增大而增大
B.CH3COOH的电离常数表达式为Ka=
C.电离常数只受温度影响,与浓度无关
D.向CH3COOH溶液中加入少量CH3COONa固体,电离常数减小
难度: 简单查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-。下列叙述错误的是( )
A.向水中通入氨气,平衡逆向移动,c(OH-)增大
B.向水中加入少量稀硫酸,c(H+)增大,Kw不变
C.将水加热平衡正向移动,Kw变大
D.升高温度,平衡正向移动,c(H+)增大,pH不变
难度: 中等查看答案及解析
-
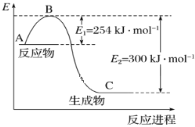
已知反应:X+Y=M+N为放热反应,则下列说法正确的是
A.断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量
B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于N
D.因为该反应为放热反应,故不必加热就可发生
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
难度: 简单查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成a mo1A,同时生成3a molB;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间内消耗a molA,同时生成3a molB;
(7)A、B、C的分子数目比为1:3:2。
A.(2)(4)(5) B.(2)(7) C.(1)(3)(4) D.(5)(6)(7)
难度: 简单查看答案及解析
-
反应NH4HS(s)
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A.温度、容积不变时,通入SO2气体
B.移走一部分NH4HS固体
C.容积不变,充入氨气
D.保持压强不变,充入氮气
难度: 简单查看答案及解析
-
在一支25mL的滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,所需NaOH溶液的体积为( )
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
难度: 简单查看答案及解析
-
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
难度: 中等查看答案及解析
-
下列诗句中能体现吸热反应的是( )
A.野火烧不尽,春风吹又生 B.千锤万凿出深山,烈火焚烧若等闲
C.暖暖远人村,依依墟里烟 D.春蚕到死丝方尽,蜡炬成灰泪始干
难度: 简单查看答案及解析
-
已知热化学方程式:SO2(g)+
O2(g)
SO3(g)△H=﹣98.32kJ/mol在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为( )
A.196.64kJ B.<196.64kJ/mol
C.<196.64kJ D.>196.64kJ
难度: 中等查看答案及解析
-
关于下图所示转化关系(X代表卤素)的说法不正确的是
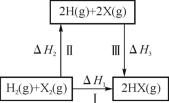
A. 2H(g)+2X(g)
2HX(g) ΔH3<0
B. 途径Ⅰ生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3
C. Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D. 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
难度: 中等查看答案及解析
-
在可逆反应2SO2+O2⇌2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,QC为浓度商)
A.QC不变,K变大,O2转化率增大
B.QC不变,K变大,SO2转化率增大
C.QC变小,K不变,O2转化率减小
D.QC增大,K不变,SO2转化率增大
难度: 中等查看答案及解析
-
下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
难度: 简单查看答案及解析
-
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为( )
A.16.7% B.50% C.66.7% D.83.3%
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O ⇌HBr+HBrO,当加入AgNO3(s)后溶液颜色变浅
B.2NO2(g) ⇌N2O4(g)(正反应放热),升高温度,可使体系颜色加深
C.反应CO+NO2⇌CO2+NO(正反应放热),升高温度,可使平衡向逆反应方向移动
D.合成氨反应N2+3H2⇌2NH3(正反应放热)中使用催化剂
难度: 简单查看答案及解析
-
如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
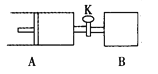
A.反应速率:v(B)<v(A) B.A容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B) D.平衡时Y的体积分数:A>B
难度: 中等查看答案及解析
-
从下列事实所得出的解释或结论正确的是
选项
实验事实
解释或结论
A
2N2O5(g)=4NO2(g)+O2(g) ΔH>0
在室温下能自发进行这是一个熵增的反应
B
压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
C
锌与稀硫酸反应过程中,开始反应后,速率逐渐增大
该反应是吸热反应
D
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动
反应物的浓度一定降低
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)
4NO2(g)+O2(g) △H>0,T1温度下的部分实验数据为
t/s
0
500
1000
1500
C(N2O5)mol/L
5.00
3.52
2.50
2.50
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10﹣3 mol/(L•s)
B.T1温度下的平衡常数为K1=125,1000s时转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2
D.平衡后其他条件不变,将容器的体积压缩到原来的
,则再平衡时c(N2O5)>5.00mol/L
难度: 中等查看答案及解析
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
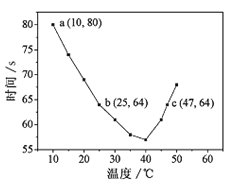
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
难度: 中等查看答案及解析
-
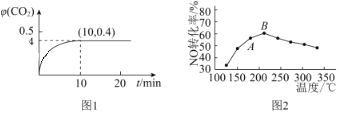
一定条件下合成乙烯:6H2(g)+2CO2(g)
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
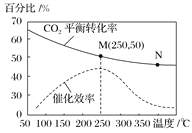
A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.将0.10 mol·L-1氨水加水稀释后,溶液中c(
)·c(OH-)变大
B.为确定某酸H2A是强酸还是弱酸,可测H2A溶液与H2SO4溶液的导电性。若导电性比硫酸弱,则H2A是弱酸。
C.将CH3COOH溶液加水稀释后,溶液中
变大
D.用0.200 0 mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
难度: 中等查看答案及解析
-
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s) + 2Cl2(g)=TiCl4(l) + O2(g) △H=+140.5 kJ/mol
C(s,石墨) + 1/2O2(g)=CO(g) △H=-110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨)=TiCl4(l) + 2CO(g) 的△H是
A. +80.5 kJ/mol B. +30.0 kJ/mol C. -30.0 kJ/mol D. -80.5 kJ/mol
难度: 中等查看答案及解析