-
下列过程或现象与盐类水解无关的是
A. 加热浓度较小的TiCl4溶液获得纳米TiO2材料
B. 粗盐在空气中易潮解
C. 加热FeCl3溶液颜色变深
D. 浓Na2S溶液有臭味
难度: 中等查看答案及解析
-
一定温度下,用水稀释0.1mol·L-1的一元弱酸HA,随稀释进行,下列数值一定增大的是(Kw表示水的离子积,Ka表示HA的电离常数)
A.Kw B.c(H+)/Ka C.c(HA)/c(A-) D.c(OH-)
难度: 中等查看答案及解析
-
下列各种情况下一定能大量共存的离子组为
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO32-、Cl-、K+
C.pH=1的溶液中:NH4+、Cl-、Cu2+、SO42-
D.无色溶液中:Al3+、HCO3-、、I-、K+
难度: 中等查看答案及解析
-
下列说法正确的是
A.0.1molAgCl和0.1 molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
B.常温下,向饱和CaCO3溶液中加入Na2CO3粉末,CaCO3的溶解度不变
C.25 ℃时,Ksp[ Mg(OH)2 ]=5.61 × 10-12、Ksp(MgF2)=7.12 ×10-11,该温度下饱和 Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+) 大
D.常温下Ksp(Ag2SO4)=1. 4× 10-5,向10mL 0.1mol/L的Na2SO4溶液中加入10 mL0.1 mol/L的AgNO3溶液,有白色沉淀生成
难度: 中等查看答案及解析
-
下列变化使所得溶液的pH=7的是
A.将25℃ pH=7的NaCl溶液加热至80℃
B.常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合
C.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合
D.常温下,0.1mol·L-1的NaAlO2溶液和0.1mol·L-1的HCl溶液按体积比1:4混合
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是
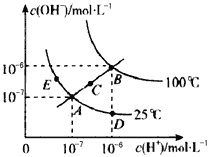
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
难度: 中等查看答案及解析
-
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述正确的是
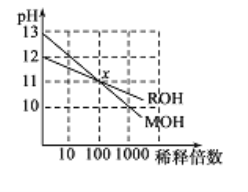
A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(MOH)=l0c(ROH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍
难度: 中等查看答案及解析