-
X、Y、Z、M、G五种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子;Y、G的单质或两元素之间形成的化合物可作水消毒剂。下列叙述正确的是( )
A.元素M的氧化物对应的水化物酸性比G的氧化物对应的水化物酸性弱
B.ZX与水的反应属于氧化还原反应
C.化合物Z2M、MY2中化学键的类型相同
D.简单离子半径的大小顺序:X<Y<Z<M<G
难度: 中等查看答案及解析
-
化学与工农业生产、日常生活、材料等有密切的联系,下列说法正确的是( )
A.华为公司自主研发的“麒麟970芯片需要以高纯度的二氧化硅为原料
B.笔、墨、纸、砚为传统的文房四宝,上述物质中的(毛)笔与(宣)纸均含有机物
C.电影《红高梁》中用高粱酿酒的原理是通过蒸馏法将高梁中的乙醇分离出来
D.有机高分子明星材料石墨烯,具有优异的光学、电学、力学和热学性质
难度: 简单查看答案及解析
-
化学与人类生产、生活密切相关,下列说法正确的是( )
A.医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
B.铁粉和生石灰均可作食品袋内的脱氧剂
C.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
D.高纤维食物是富含膳食纤维的食物,在人体内都可通过水解反应提供能量
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol氨基(-NH2)中所含的质子数为9NA
B.标准状况下,22.4 L单质溴所含有的原子数目为2NA
C.100 mL 0.1 mol·L−1 CH3COONa溶液含CH3COO−的数目是0.01NA
D.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.22.4L二氯甲烷的分子数约为NA个
B.0.1molFe(OH)3胶体,含有胶体粒子的数目为0.1NA
C.1molNa2O2与足量CO2充分反应转移的电子数目为2NA
D.加热条件下,含0.2molH2SO4的浓溶液与足量铜反应,生成SO2的分子数小于0.1NA
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的前20号元素,最外层电子数之和为15,X-具有很强的还原性,Y和Z原子的L层均达到8电子结构,Z-和W+具有相同的电子层结构。下列叙述正确的是
A. 离子半径大小:W+>Y2->Z-
B. 单质的沸点:Y>Z>X
C. 氧化物的水化物的酸性:Y<Z
D. 元素X和Y、Z、W都能形成共价化合物
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+ H2O = 2H++ Cl-+ ClO-
B.氧化亚铁溶于稀硝酸:FeO + 2H+=Fe2+ + H2O
C.向三氯化铝溶液中滴入过量氨水:Al3++3NH3·H2O =Al(OH)3↓+3NH4+
D.金属钠投入水中:Na + 2H2O =Na++ 2OH-+ H2↑
难度: 简单查看答案及解析
-
下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2OC.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
难度: 中等查看答案及解析
-
如图为一原电池工作原理示意图,电池工作过程中左右两烧杯所盛放的溶液中不允许引入杂质。下列有关说法中正确的是( )
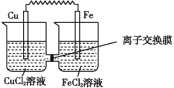
A.所用离子交换膜为阳离子交换膜
B.Cu电极的电极反应为Cu-2e-=Cu2+
C.电池工作过程中,CuCl2溶液浓度降低
D.Fe为负极,电极反应为Fe2++2e-=Fe
难度: 中等查看答案及解析
-
根据下图,有关金属的腐蚀与防护的叙述正确的是
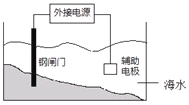
A.钢闸门含铁量高,无需外接电源保护
B.该装置的原理是“牺牲阳极的阴极保护法”
C.将钢闸门与直流电源的负极相连可防止其被腐蚀
D.辅助电极最好接锌质材料的电极
难度: 中等查看答案及解析
-
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项
①中物质
②中物质
②中预测的现象
A
浓氨水
块状CaO
产生刺激性气味气体
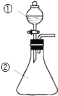
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
浓盐酸
MnO2粉末
产生黄绿色气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是(部分夹持装置已略去)( )
A.
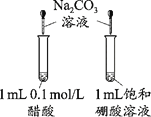 证明醋酸酸性比硼酸强
证明醋酸酸性比硼酸强B.
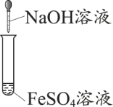 实验室制氢氧化亚铁
实验室制氢氧化亚铁C.
 实验室制氨气
实验室制氨气D.
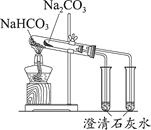 证明碳酸氢钠热稳定性比碳酸钠弱
证明碳酸氢钠热稳定性比碳酸钠弱难度: 简单查看答案及解析
-
一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:

下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
难度: 困难查看答案及解析
-
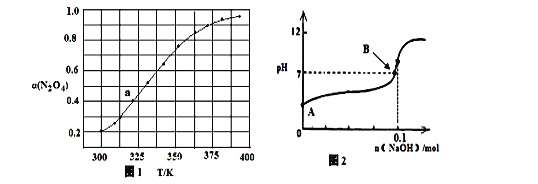
常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=
]下列说法正确的是
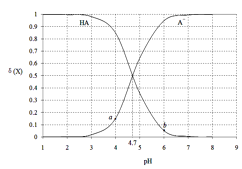
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
难度: 简单查看答案及解析
-
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
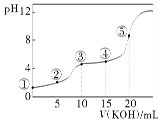
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
难度: 困难查看答案及解析
-
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
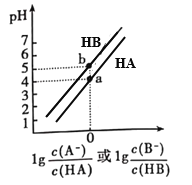
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
难度: 中等查看答案及解析