-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
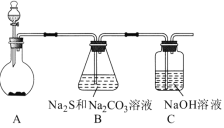
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O3•5H2O晶体。
(5)称取10.0g产品(Na2S2O3•5H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
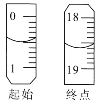
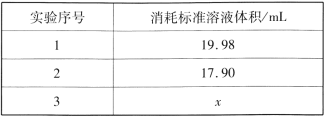
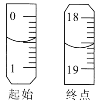
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。
-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
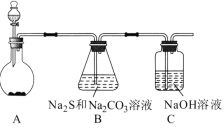
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O3•5H2O晶体。
(5)称取10.0g产品(Na2S2O3•5H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。
-
硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
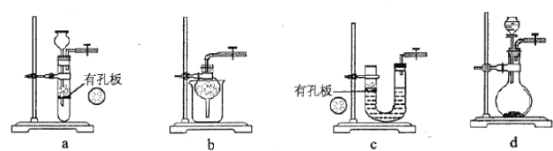
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填标号);检查该装置气密性的操作是:关闭止水夹,再_____________。
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无味的气体产生,则反应的化学方程式为____________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为____(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________________。
-
硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛.将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O(大苏打).

(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是_____(选填编号);检查该装置气密性的操作是:关闭止水夹,再_______________。
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为__________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为_______________(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为_________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________。
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32﹣+I3﹣=S4O62﹣+3I﹣.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是___________。
②取2.500g含杂质的Na2S2O3•5H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.98 | 20.02 | |
到达滴定终点的现象是_______________;Na2S2O3•5H2O(式量248)的质量分数是(保留4位小数)__________。
-
Na2S2O3是重要的工业原料,课外小组以SO2为原料制取Na2S2O3的实验步骤如下:
I. 配制混合溶液
将Na2S和Na2CO3按2:1的物质的量之比混合,加入一定量的水,形成溶液。
II.预热、充分反应
将该溶液注入敞口反应釜中,加热反应釜一段时间,向反应釜中缓慢通入SO2至稍过量。
III.蒸发浓缩、冷却结晶
反应结束后加热浓缩溶液,冷却至30℃以下,析出大量Na2S2O3 • 5H2O。
IV.过滤、循环反应
滤出Na2S2O3 • 5H2O,烘干脱去结晶水,母液循环利用。
回答下列问题:
(1)步骤II预热时温度不宜过高,应将温度控制在50℃左右,其主要目的是____________。
(2)步骤II充分反应时的化学方程式为_______________________。
(3)步骤IV中的母液循环利用,其目的是在节约成本、减少污染的同时,提高________。
(4)为测定所得Na2S2O3产品的纯度,称取w g烘干后的Na2S2O3产品,先用适量蒸馏水溶解,再用a mol • L-1碘的标准溶液滴定(2S2O32-+I2=2I-+S4O62-,且不考虑杂质与碘反应),以淀粉溶液作指示剂,滴定至终点时的现象为_________________。
若消耗碘的标准溶液的体积为b mL,则所得产品的纯度为_______________。
-
Na2S2O3是重要的工业原料,课外小组以SO2为原料制取Na2S2O3的实验步骤如下:
I. 配制混合溶液
将Na2S和Na2CO3按2:1的物质的量之比混合,加入一定量的水,形成溶液。
II.预热、充分反应
将该溶液注入敞口反应釜中,加热反应釜一段时间,向反应釜中缓慢通入SO2至稍过量。
III.蒸发浓缩、冷却结晶
反应结束后加热浓缩溶液,冷却至30℃以下,析出大量Na2S2O3 • 5H2O。
IV.过滤、循环反应
滤出Na2S2O3 • 5H2O,烘干脱去结晶水,母液循环利用。
回答下列问题:
(1)步骤II预热时温度不宜过高,应将温度控制在50℃左右,其主要目的是____________。
(2)步骤II充分反应时的化学方程式为_______________________。
(3)步骤IV中的母液循环利用,其目的是在节约成本、减少污染的同时,提高________。
(4)为测定所得Na2S2O3产品的纯度,称取w g烘干后的Na2S2O3产品,先用适量蒸馏水溶解,再用a mol • L-1碘的标准溶液滴定(2S2O32-+I2=2I-+S4O62-,且不考虑杂质与碘反应),以淀粉溶液作指示剂,滴定至终点时的现象为_________________。
若消耗碘的标准溶液的体积为b mL,则所得产品的纯度为_______________。
-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq) Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
实验室拟用如下实验装置在C中制备Na2S2O3。
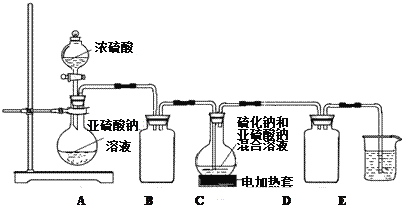
请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为__________________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_______________________________________________________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
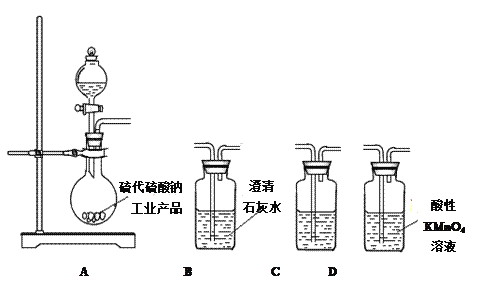
①实验装置的连接顺序依次_________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq) Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
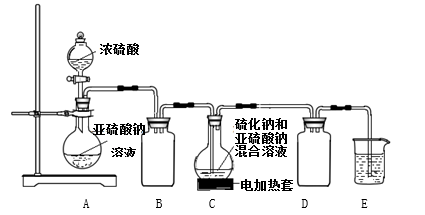
请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为_________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
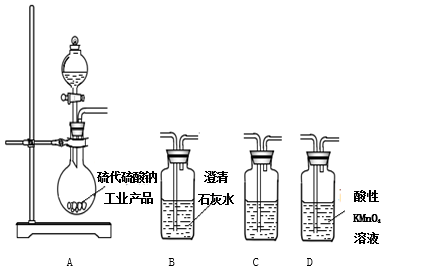
①实验装置的连接顺序依次________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
-
由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

-
由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。
















