-
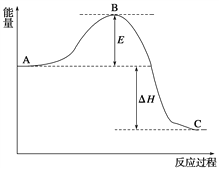
纯净的水呈中性,这是因为( )
A.纯水中c(H+)= c(OH-) B.纯水pH=7
C.纯水的离子积Kw=1.0×10-14 D.纯水中无H+也无OH-
难度: 中等查看答案及解析
-
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A. C(s)+1/2O2(g)=CO(g);△H=-393.5kJ/mol
B. 2H2(g)+O2(g)=2H2O(g);△H=+571.6kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D. 1/2C6H12O6(g)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ/mol
难度: 简单查看答案及解析
-
一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化 ④单位时间内生成nmolZ,同时生成nmolX
A.①② B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
相同条件下,下列关于反应速率的判断正确的是
A.0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2mol·L-1的NaOH溶液反应的速率相同
B.0.1 mol·L-1的盐酸和0.1 mol·L-1的硝酸分别与大小相同的大理石反应的速率相同
C.Mg和Fe分别与0.1 mol·L-1的盐酸反应的速率相同
D.大理石块与大理石粉分别与0.1 mol·L-1的盐酸反应的速率相同
难度: 简单查看答案及解析
-
根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( )
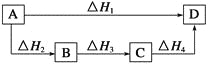
A.ΔH1=ΔH2=ΔH3=ΔH4 B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4 D.ΔH1=ΔH2+ΔH3+ΔH4
难度: 简单查看答案及解析
-
一定条件下,可逆反应X(s)+Y(g)⇌ W(g)+Z(g)△H>0,在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(υ)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )
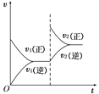
A.增加了X的物质的量 B.降低了温度
C.增大了压强 D.增大了Y的物质的量
难度: 简单查看答案及解析
-
在恒温、体积为2L的密闭容器中进行反应:2A(g)
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为
A.υ(B)=0.045mol/(L·s) B.υ(B)=0.03mol/(L·s)
C.υ(C)=0.03mol/(L·s) D.υ(C)=0.06mol/(L·s)
难度: 简单查看答案及解析
-
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
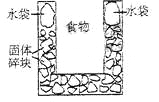
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
难度: 中等查看答案及解析
-
对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率
B.同等程度改变正逆反应速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
难度: 简单查看答案及解析
-
已知: (1)Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s),ΔH=+234.1kJ•mol-1
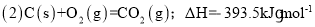 则
则的ΔH是( )
A.-824.4 kJ•mol-1 B.-627.6kJ•mol-1 C.-744.7kJ•mol-1 D.-169.4kJ•mol-1
难度: 中等查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应: 2A(g)+B(g)
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法正确的是( )
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol·L-1
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.0.1 mol·L-1CH3COOH溶液的pH>1,可知CH3COOH溶液中存在CH3COOH
CH3COO-+H+
C.能导电的物质一定是电解质
D.弱电解质的电离程度越大,导电能力越强
难度: 简单查看答案及解析
-
在一定条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A.SO2(g)+
O2(g)
SO3(g) ΔH=-98.3 kJ/mol
B.2SO2(g)+O2(g)
SO3(l) ΔH=-196.6 kJ/mol
C.SO2(g)+
O2(g)
SO3(g) ΔH=-122.9 kJ/mol
D.2SO2(g)+O2(g)
SO3(g) ΔH=+196.6 kJ/mol
难度: 简单查看答案及解析
-
在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A. 等于0.6mol B. 等于1mol
C. 大于0.6mol且小于1mol D. 大于1mol
难度: 中等查看答案及解析
-
在一个容积为VL的密闭容器中放入2LA(g)和1L B(g),在一定条件下发生下列反应3A(g)十B(g)
nC(g)+2D(g) 达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
在某温度下,可逆反应mA + nB
pC + qD的平衡常数为K,下列说法正确的是
A. K越大,达到平衡时,反应进行的程度越大
B. K越小,达到平衡时,反应物的转化率越大
C. K随反应物浓度的改变而改变
D. K随温度和压强的改变而改变
难度: 困难查看答案及解析
-
下图为可逆反应A(g)+2B(g)
nC(g)△H>0生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是 ( )
A.p2>p1,n<3
B.p2>p1,n>3
C.p1>p2,n<3
D.p1>p2,n>3
难度: 中等查看答案及解析
-
把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
难度: 困难查看答案及解析
-
下列有关化学反应速率的认识正确的是( )
A.对于任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.增大反应物的量,化学反应速率不一定加快
难度: 中等查看答案及解析