-
25℃时,0.1 mol/L下列溶液的pH如下表,有关比较正确的是
序号
①
②
③
④
⑤
溶液
NaCl
CH3COONH4
NaClO
NaHCO3
Na2CO3
pH
7.0
7.0
10.3
8.3
11.6
A. 酸性的相对强弱:HClO<HCO3-
B. 由水电离产生的c(H+):①=②
C. 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-)
D. 在④⑤溶液等体积混合后的溶液中:c(HCO3-) + c(CO32-) + c(H2CO3)=0.1 mol/L
难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
下列离子组一定不能大量共存的是( )
A.K+ 、Na+、CO32-、NO3- B.NH4+、HCO3-、NO3-、Na+
C.Al3+、HCO3-、NO3-、Cl - D.SiO32-、Na+、K+、NO3-
难度: 简单查看答案及解析
-
下列与盐的水解有关的是( )
①不能用Al2(SO4)3溶液与Na2S溶液反应制备Al2S3固体
②NaHCO3溶液与Al2(SO4)3溶液可做泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.只有①②③ B.只有②③④ C.只有①④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下列关于右图所示装置的叙述,不正确的是
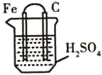
A.铁是负极,铁失去电子形成Fe2+进入溶液
B.铁片质量逐渐减少,碳棒上有气泡产生
C.电流由铁片经导线沿外电路流向碳棒
D.该装置总的化学反应为
难度: 简单查看答案及解析
-
下列各式中属于正确的水解反应离子方程式的是( )
A.NH4++H2O⇌NH3·H2O+H+ B.S2-+2H2O⇌H2S+2OH-
C.CH3COOH+H2O⇌CH3COO-+H3O+ D.CH3COOH+OH-⇌CH3COO-+H2O
难度: 简单查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 简单查看答案及解析
-
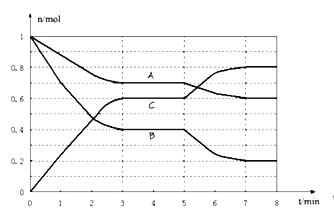
可以证明可逆反应N2+3H2⇌2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤N2、H2、NH3的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6mol•L-1•min-1,逆反应速率v(NH3)=0.1mol•L-1•min-1
A.全部 B.②③④⑤ C.②③④⑤⑦ D.③⑤⑥⑦
难度: 中等查看答案及解析
-
一定条件下:Na2CO3溶液中存在如下平衡:CO32-+H2O⇌HCO3-+OH-,下列说法正确的是( )
A.稀释溶液平衡正向移动,
增大
B.通入CO2平衡逆向移动,溶液pH减小
C.加入Al2(SO4)3溶液,会产生Al2(CO3)3沉淀
D.升高温度,
增大
难度: 中等查看答案及解析
-
已知碳酸、亚硫酸、次氯酸的平衡常数如下表:
H2CO3
H2SO3
HClO
K1=4.30×10-7
K1=1.54×10-2
K=2.95×10-8
K2=5.61×10-11
K2=1.02×10-7
下列说法正确的是( )
A. 相同条件下,同浓度的H2SO3 溶液和 H2CO3 溶液的酸性,后者更强
B. Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32-
C. NaHCO3溶液中通少量SO2:2HCO3-+SO2=CO2+SO32-+H2O
D. 向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度
难度: 困难查看答案及解析
-
温度相同、浓度均为0.1mol•L-1的 ①(NH4)2SO4 ②NH3·H2O ③NH4HSO4 ④NH4NO3 ⑤(NH4)2CO3 ⑥NH4Fe(SO4)2 溶液中的c(NH4+)由大到小的顺序是( )
A.①⑤③⑥④② B.⑤①③④②⑥
C.③②①⑥④⑤ D.⑤①②⑥④③
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
选项
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度均为0.lmol·L-1的的NaClO溶液和CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向AgCl悬浊液中滴入0.lmol·L-1的的NaI溶液,悬浊液变黄
证明相同温度下:Ksp(AgCl)>Ksp(AgI)
C
常温下,测得饱和溶液的pH: NaA>NaB
证明常温下的水解程度:A-<B-
D
酸式滴定管中硫酸液面在20.00mL处,将滴定管中液体全部放出
量取20.00mL硫酸溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有关下列两种溶液的说法中,正确的是( )
①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液
A.相同温度下,溶液中水的电离度:溶液①>溶液②
B.等体积混合溶液①和溶液②,所得溶液中c(Na+)>c( CH3COO-)>c(H+)>c(OH-)
C.加水稀释溶液①,溶液中
不变
D.向溶液①中加入少量的CH3COONa固体则
减小
难度: 中等查看答案及解析
-
t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )
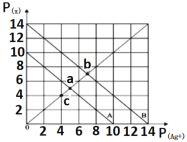
A.c点可表示AgCl的不饱和溶液
B.b点的AgCl溶液加入AgNO3晶体可以变成a点
C.t℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)平衡常数K=10-4
D.t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
难度: 中等查看答案及解析
-
绝热恒容密闭容器通入SO2和NO2 ,一定条件下SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
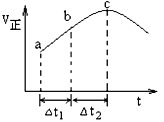
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于c点
C.△t1=△t2时,SO2的转化率:b-c段大于a-b段
D.反应在c点达到平衡状态
难度: 中等查看答案及解析
-
向某Na2CO3、 NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中lg
与-lgc(Ba2+)的关系如图所示,下列说法不正确的是( )
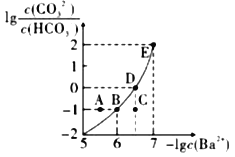
A.该溶液中
<
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差,有沉淀生成
D.D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32-)+c(OH-)+c(Cl-)
难度: 中等查看答案及解析