-
下列有关化学用语使用正确的是
A.石英的分子式:SiO2
B.NH4Cl的电子式:

C.Br原子的基态简化电子排布式为4s24p5
D.基态碳原子的价电子轨道表示式为
难度: 中等查看答案及解析
-
下列说法正确的是
A.Zn元素位于周期表的d区
B.第四周期中,最外层有两个电子的元素有9种
C.催化剂能加快化学反应速率,提高反应物的转化率
D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
难度: 中等查看答案及解析
-
下列叙述中错误的是
A.酸性:HClO4>H2SO4>H3PO4 B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.离子半径:Cl->S2->O2-
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=2 mol·L-1·min-1 B.v(A)=0.2 mol·L-1·s-1
C.v(C)=0.1 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.Na+的电子排布式为1s22s22p63s1
B.SO2分子的结构按VSEPR模型是V形
C.HF的分子间作用力大于HCl,故HF比HCl更稳定
D.有机物CH2=CH-CH3中杂化类型有sp3 和sp2,其中有一个π键,2个σ键
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1mol NaHSO4熔融态时含有2NA个离子
C.含32g硫原子的CS2分子中含有的σ键数目为2NA
D.常温常压下,10 g D2O含有的质子数、电子数、中子数均为5NA
难度: 中等查看答案及解析
-
下列说法错误的是
A.钠元素的第二电离能大于镁元素的第二电离能
B.基态氧原子有8种能量不同的电子
C.锂原子的2s和5s轨道皆为球形分布
D.N2与CO互为等电子体,它们具有相似的化学键特征和许多相似的性质
难度: 中等查看答案及解析
-
下列实验操作不正确的是
实验目的
实验操作
A
验证化学反应中的能量变化
将NO2球浸泡在冰水,热水中观察颜色变化
B
证明非金属性:Cl>C>Si
将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中
C
探究相同条件下,溶液浓度对反应速率的影响
在两支试管中各加入4 mL 0.01 mol/L的KMnO4酸性溶液,再分别加入0.1 mol/L H2C2O4溶液2 mL、0.2 mol/L H2C2O4 溶液2 mL,分别记录溶液褪色所需时间
D
除去氢氧化铁中少量的氢氧化铜
将过量氨水加入混合物中并充分搅拌,然后过滤、洗涤、干燥
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
能够说明氯的非金属性比硫强的事实有
①HCl的酸性强于H2S的酸性
②将氯气通入H2S溶液中可置换出硫
③氯气与铁反应生成FeCl3,硫与铁反应生成FeS
④硫和氯变成简单阴离子时硫原子得到的电子更多
⑤氯气和氢气的混合气,经强光照射可剧烈反应,而硫与氢气反应需较高温度
A.②③⑤ B.①④⑤ C.②③④ D.①②③⑤
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.188 kJ D.436 kJ
难度: 中等查看答案及解析
-
一定温度下,一固定体积的密闭容器中发生反应:A(s)+3B(g)
2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
①混合气体的压强不再变化
②单位时间内生成2a mol C,同时生成3a mol B
③气体密度不再变化
④A的质量不再变化
⑤气体的平均相对分子质量不再变化
⑥2v逆(C)=3v正(B)
A.①③ B.②⑤ C.①⑥ D.④⑤
难度: 中等查看答案及解析
-
化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据结构和组成相似的物质,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3
C.根据价电子构型与化合价的关系,推出最外层电子数3个的元素一定是第ⅢA族元素
D.根据反应物浓度越大反应速率越快,推出常温下相同的铝片中分别加入足量的浓硝酸和稀硝酸中,浓硝酸中铝片先溶解完
难度: 中等查看答案及解析
-
下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
B.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
C.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
D.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
难度: 中等查看答案及解析
-
在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.打开可乐瓶有大量泡沫冒出
B.新制的氯水在光照下颜色变浅
C.用饱和食盐水除去氯气中氯化氢杂质
D.容器中有H2(g)+I2(g)
2HI(g),增大压强颜色变深
难度: 中等查看答案及解析
-
在密闭容器中反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度为0.2mol/L。下列判断正确的是
A.x+y>z B.B的转化率降低
C.C的体积分数减小 D.平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
B.氢气的燃烧热为-285.5 kJ·mol-1,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g)放热19.3 kJ,热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-38.6 kJ·mol-1
难度: 中等查看答案及解析
-
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
2HI(g) ΔH<0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数
1min
2min
3min
4min
5min
6min
7min
条件I
26%
42%
52%
57%
60%
60%
60%
条件Ⅱ
20%
33%
43%
52%
57%
65%
65%
下列说法中正确的是
A.在条件I下,该反应的平衡常数K=10
B.在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C.在条件Ⅱ下,到达平衡时,I2(g)的转化率为81.25%
D.与条件I相比,为达到条件Ⅱ的数据,可能改变的条件是降低压强
难度: 中等查看答案及解析
-
W、X、Y、Z是四种短周期主族元素,原于序数依次增大,W的一种原子核内无中子,X、Y原子核外 L电子层的电子数之比为3:4,Y, Z位于同一周期,Z的一种单质常温下是淡黄色晶体,四种元素的原子最 外层电子数之和为14。下列说法错误的是()
A. X与其它三种元素均能形成二种二元化合物
B. X、Z阴离子的还原性强弱:Z>X
C. X、Y的简单离子半径大小:X>Y
D. X和Z的简单氢化物沸点;X<Z
难度: 中等查看答案及解析
-
如下图,向Ⅰ中充入1molX、1molY,向Ⅱ中充入2molX、2molY,起始时Ⅰ、Ⅱ的体积相等都等于a L,在相同温度和催化剂存在的条件下,两容器中各自发生下述反应,X(g)+Y(g)
2Z(g)+W(g) ΔH<0。Ⅰ保持恒压,Ⅱ保持恒容,达平衡时,Ⅰ的体积为1.4a L。下列说法错误的是
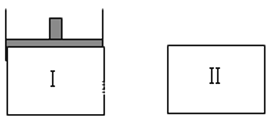
A.Ⅰ容器中X的转化率为80%
B.从起始到平衡所需时间:Ⅰ>Ⅱ
C.平衡时Y体积分数:Ⅰ<Ⅱ
D.平衡时的压强:PⅡ>2PⅠ
难度: 中等查看答案及解析