-
“低碳经济”是建设美丽中国的发展方向。
(1) 已知:① CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
② 2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③ 2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2) 二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比n(H2)/n(CO)的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。

①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
-
“低碳经济”是建设美丽中国的发展方向。
(1)已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1kJ/mol
②2H2(g)+CO(g)=CH3OH(l) ΔH2=-128.3kJ/mol
③2H2(g)+O2(g)=2H2O(g) ΔH3=-481.9kJ/mol
常温下,在合适催化剂的作用下,采用CH4和O2一步合成液态CH3OH的热化学方程式为____。
(2)二甲醚(CH3OCH3)是清洁能源。利用合成气合成二甲醚的原理是2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比
CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比 的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。
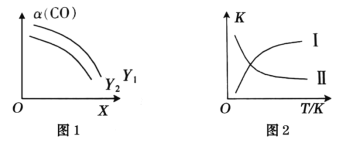
①图1中,X代表____;Y1____Y2 (填“>”“<”或“=”)。
②图2中,曲线____(填I或II)符合平衡常数变化规律。
(3)在1L恒容密闭容器中充入2a(a>0)molH2和a mol CO,在一定条件下合成甲醇,CO(g)+2H2(g) CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
①在该温度下,平衡常数K=____ (用代数式表示)。
②在该温度下,向此平衡体系中加入a mol CH3OH(g),再次达到平衡后CO的转化率将____(填“增大”“减小”或“不变”)
③下列情况表明反应达到平衡状态的是____
A. 不再改变
不再改变
B.CO的消耗速率等于CH3OH的生成速率
C.混合气体的密度不再改变
D.混合气体的平均摩尔质量不再改变
-
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g) CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
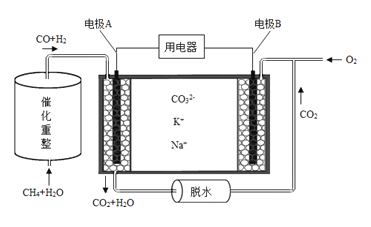
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
-
已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H1
CO2(g)+H2(g) △H1
②CH4(g)+H2O(g) CO(g)+3H2(g) △H2
CO(g)+3H2(g) △H2
下列推断正确的是
A.若CO的燃烧热为△H3,则H2的燃烧热为△H3−△H1
B.反应CH4(g)+ CO2(g) 2CO(g)+2H2(g)的△H=△H2−△H1
2CO(g)+2H2(g)的△H=△H2−△H1
C.若反应②的反应物总能量低于生成物总能量,则△H2<0
D.若等物质的量CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0
-
第一题:已知:
①CH4(g) + H2O(g)  CO(g) + 3H2(g) ∆H1 = +206.4 kJ/mol
CO(g) + 3H2(g) ∆H1 = +206.4 kJ/mol
②CO(g) + H2O(g)  CO2(g) + H2(g) ∆H2 = -41.0 kJ/mol
CO2(g) + H2(g) ∆H2 = -41.0 kJ/mol
③CH4 (g) + 2H2O(g)  CO2(g) + 4H2(g) ∆H3
CO2(g) + 4H2(g) ∆H3
请回答:
(1)反应①属于 (填“吸热”或“放热”)反应。
(2)反应①消耗8 g CH4 (g)时,∆H = kJ/mol。
(3)反应②生成2 mol H2(g)时,∆H = ___________ kJ/mol。
(4)反应③的∆H3 =___________ kJ/mol。
第二题:在容积为1.00 L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g) 2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。

请回答:
(1)60 s内,v(N2O4) = mol/(L·s)。
(2)若升高温度,混合气体的颜色变深,则正反应是 (填“放热”或“吸热”)反应。
(3)100℃时,该反应的化学平衡常数数值为 。
(4)平衡时,N2O4的转化率是 。
-
(12分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g)  CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
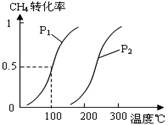
(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1________0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2________0,△S________0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值(写出计算过程及结果)
-
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g)  CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
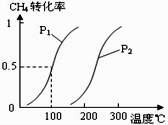
(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1____0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2____0,△S____0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值____________(写出计算过程及结果)
-
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
①CH4(g)+H2O(g) CO(g)+3H2(g)△H1
②CO(g)+2H2(g) CH3OH(g)△H2
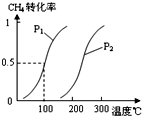
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生①反应,达到平衡时,CH4的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率________(填“增大”、“减小”或“不变”),平衡向________方向移动.
(2)反应①的△H1________0(填“<”、“=”或“>”).
(3)如果反应①达到平衡时所用的时间为2min,求CH4的反应速率及化学平衡常数的值.(写出计算过程).
(4)在100℃压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行②反应,生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 |  | 0.1 |
| II | | | 5 |
| III | 350 | | 5 |
-
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
② CO(g)+2 H2(g)
H2(g)  CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20mol CH4(g)和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
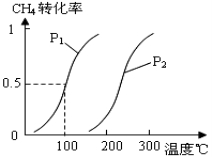
(1)温度不变,缩小体积,增大压强,①的反应速率 ______(填“增大”、“减小”或“不变”),平衡向 ___方向移动。
(2)温度升高,反应①的ΔH1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 ______。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3 a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | | | 5 |
| III | 350 | | 5 |
-
甲烷液化可获得工业原料甲醇,反应原理是:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0 kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0 kJ·mol-1
下列说法不正确的是
A. 升高温度,反应①中CH4转化率提高
B. 反应③是CO2资源化利用的方法之一
C. CO(g)+2H2(g)===CH3OH(g) ΔH=-90.0 kJ·mol-1
D. 上述合成甲醇过程中需要向原料气中补充H2
CH3OCH3(g)+H2O(g) ΔH<0。在一定条件下,在反应中CO的平衡转化率α(CO)与温度(T)、投料比
的关系如图1所示,平衡常数K与温度(T)的关系如图2所示。

CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
不再改变






