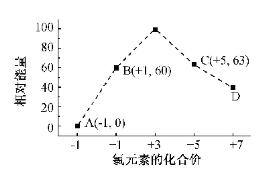
-
下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂 B.盐类都可作调味品
C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分
难度: 简单查看答案及解析
-
下列关于乙醇的说法不正确的是
A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
难度: 中等查看答案及解析
-
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是

A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -)
D.温度升高,c(HCO3- )增大
难度: 困难查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
在一定条件下,N2O分解的部分实验数据如下:

下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
 、
、难度: 中等查看答案及解析