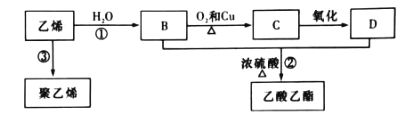
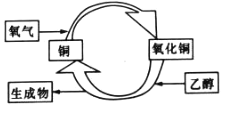
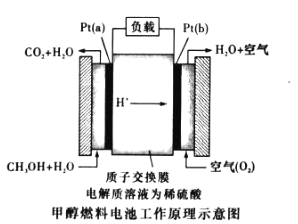
-
有些古文或谚语包含了丰富的化学知识。下列解释错误的是
选项
古文或谚语
化学解释
A
日照香炉生紫烟
碘的升华
B
以曾青涂铁,铁赤色如铜
置换反应
C
煮豆燃豆萁
化学能转化为热能、光能
D
雷雨肥庄稼
自然固氮
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列粒子半径最大的是
A.F- B.O2- C.Na+ D.Al3+
难度: 简单查看答案及解析
-
下列叙述正确的是
A.葡萄糖在人体内的氧化反应是放热反应
B.某些物质在空气中燃烧是吸热反应
C.强酸、强碱的中和反应是放热反应,弱酸、弱碱的中和反应是吸热反应
D.铝分别与盐酸和稀硫酸反应,前者是放热反应,后者是吸热反应
难度: 简单查看答案及解析
-
下列气态氢化物中 ,最稳定的是
A.PH3 B.NH3 C.H2O D.H2S
难度: 简单查看答案及解析
-
下列实验中,不能观察到明显变化的是
A.把稀盐酸逐滴滴加到稀氢氧化钠溶液中
B.把 Cl2通入 FeCl2溶液中
C.把绿豆大的钾投入少量水中
D.把溴水滴加到淀粉-KI溶液中
难度: 中等查看答案及解析
-
相同条件下,等质量的碳分别燃烧生成CO和CO2所放出的热量,前者与后者的关系是
A.前者大 B.后者大 C.相等 D.不能肯定
难度: 简单查看答案及解析
-
取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别摘加69% HNO3,98.3% H2SO4和新制氯水,三张试纸最后呈现的颜色依次为
A.白 红 白 B.红 黑 红 C.红 红 红 D.白 黑 白
难度: 中等查看答案及解析
-
正丁烷与异丁烷互为同分异构体的依据是
A.具有相似的化学性质 B.具有相同的物理性质
C.分子具有相同的空间结构 D.分子式相同,但分子内碳原子的连接方式不同
难度: 简单查看答案及解析
-
下列过程中.所发生的化学变化属于取代反应的是
A.甲烷在空气中点燃
B.乙烯通入溴的四氯化碳溶液中
C.在镍作催化剂的条件下,苯与氢气反应
D.苯与液溴混合后撒入铁粉
难度: 简单查看答案及解析
-
常温、常压下,1mol下列各有机物分别在足量的氧气中完全燃烧,消耗氧气最多的是
A.甲烷 B.乙烯 C.乙醇 D.苯
难度: 简单查看答案及解析
-
下列对图示“石蜡油(液态烷烃混合物)催化分解”实验的说法正确的是
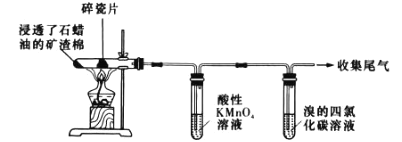
A.碎瓷片可以防止加热时石蜡油暴沸
B.收集的尾气的主要成分为气态烷烃
C.该实验能证明石蜡油分解产生了乙烯
D.酸性 KMnO4溶液褪色,发生的是加成反应
难度: 简单查看答案及解析
-
下列反应原理不能设计成原电池的是
A.Zn+2H+=Zn2++H2↑
B.2Fe3++Fe=3Fe2+
C.2Al+2OH-+2H2O =2AlO
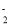 +3 H2↑
+3 H2↑D.Cu+2H+=Cu2++H2↑
难度: 简单查看答案及解析

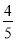 v(NH3)=v (O2) B.
v(NH3)=v (O2) B.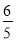 v (O2) =v(H2O)
v (O2) =v(H2O)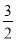 v(H2O) D.v(O2) =
v(H2O) D.v(O2) =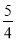 v(NO)
v(NO)