-
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量________(填“大于”“小于”或“等于”) 725.76kJ。
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)⇌CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是________(填字母代号)。
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4 的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为___________。
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:
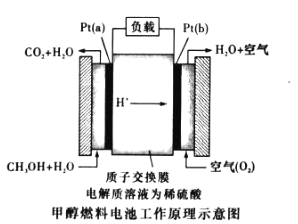
①P t (a)电极是电池的________极,电极反应式为_____________ 。
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH___g。
-
开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ•mol-1。
CH3OH(g) △H= -90.8kJ•mol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)⇌CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
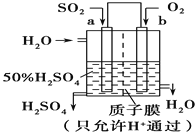
(2)①氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
②科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
-
甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答:
①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
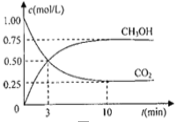
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使v(CO2)增大的是 .
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H-H键断裂
-
(10分)(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
-
Ⅰ.下表是几种常用燃料的燃烧热:1 mol燃料完全燃烧(生成物中的H2O为液态)时放出的热量。
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是 。
(2)写出乙醇完全燃烧的热化学方程式 。
Ⅱ.氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题
(1)分解海水时,实现了从光能转化为 能。生成的氢气用于燃料电池时,实现了化学能转化为 能。分解海水的反应属于 反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A、B两极上发生的电极反应分别为 A极:2H2+2O2--4e-===2H2O,则A极是电池的 极,电子从该极 (填“流入”或“流出”)。B极电极反应式 。
Ⅲ.钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中生锈时主要发生 腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的 极,正极的电极反应为 。
-
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 ________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)=H2O(g) △H =-241.8 kJ·mol-1
O2(g)=H2O(g) △H =-241.8 kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),正极发生的电极反应式为 ________ 。负极发生的电极反应式为 ________ 。
-
N2H4是一种高效清洁的火箭燃料。已知在25℃、101 kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
-
N2H4是一种高效清洁的火箭燃料。已知在25℃、101 kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
-
N2H4是一种高效清洁的火箭燃料。已知在25℃、101 kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
-
甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。


