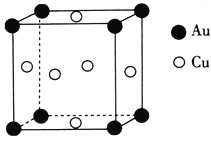
-
下列说法正确的是
A. 二氧化硫可用于杀菌、消毒
B. 煤经过气化和液化等物理变化可转化为清洁能源
C. 氯气和明矾均可做自来水的消毒剂
D. 食品保鲜剂中所含铁粉和生石灰均作还原剂
难度: 简单查看答案及解析
-
下列溶液配制实验的描述完全正确的是
A. 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L-1 )通常需要用容量瓶等仪器
C. 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解
D. 用pH=1的盐酸配制100mLpH=2的盐酸所需全部玻璃仪器有100mL容量瓶、烧杯、玻璃棒、胶头滴管
难度: 中等查看答案及解析
-
日常生活离不开洗涤剂
 下列有关洗涤剂的使用不正确的是
下列有关洗涤剂的使用不正确的是A. 用纯碱溶液清洗餐具上油污 B. 用稀硫酸清洗水壶里水垢
C. 用漂白液洗涤白衬衣上红色墨迹 D. 用汽油清洗皮肤上的油漆
难度: 中等查看答案及解析
-
要将NaOH高温熔化,下列坩埚中可选用的是
A. 普通玻璃坩埚 B. 石英玻璃坩埚 C. 氧化铝坩埚 D. 铁坩埚
难度: 简单查看答案及解析
-
按如图装置进行实验,下列推断正确的是( )
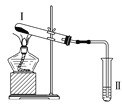
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
铁粉与水蒸气发生了反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是
CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是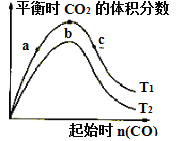
A. T1比T2高
B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高
D. 减小压强可提高CO、SO2转化率
难度: 中等查看答案及解析
-
元素及其化合物的转化关系是化学学习的重要内容之一,下列各组物质的各步转化均可以通过一步反应完成的是
A. N2→NO2→HNO3→NO B. Al→Al2O3→Al(OH)3→AlCl3
C. Si→SiO2→H2SiO3→Na2SiO3 D. Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中,一定可以大量共存的是
A. 在pH=12的溶液中 Na+、K+、CH3COO-、SO42-
B. 使石蕊变红的溶液中 NH4+、Ba2+、HCO3-、NO3-
C. 含Fe3+的溶液中 H+、K+、Br-、I-
D. 无色溶液中 Cu2+、Al3+、SO42-、[Al(OH)4]-
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是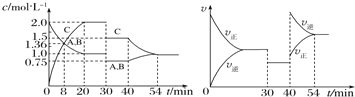
A. 30—40min间该反应使用了催化剂 B. 反应方程式中的x=1,正反应为吸热反应
C. 30min时降低温度,40min时升高温度 D. 8min前A的反应速率为0.08mol/L·min
难度: 困难查看答案及解析
-
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图
 下列说法正确的是
下列说法正确的是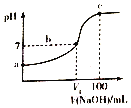
A. a点溶液的pH=4
B. b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-)
C. b点c(HA)/c(A-)=5
D. c点c(A-)+c(H+)=c(Na+)+c(OH-)
难度: 困难查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
 pC(g)的速率和平衡的影响图象如下,下列判断正确的是
pC(g)的速率和平衡的影响图象如下,下列判断正确的是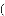

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
下表是周期表的一部分,其中X、Y、Z、W为短周期主族元素,下列说法正确的是
X
Y
Z
W
A. W的最高价氧化物对应的水化物一定是强酸 B. Z的单质一定能溶于稀硫酸中
C. 四种元素的最高正化合价均等于其族序数 D. 四种原子中,Z的原子半径最小
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等,下列判断不正确的是
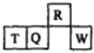
A. 最简单气态氢化物的热稳定性:R>Q B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R D. 含T的盐溶液一定能与碱反应
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b
B. 混合溶液的PH=7
C. 混合溶液中,c(H+)=
 mol.L-1
mol.L-1D. 混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
难度: 中等查看答案及解析
-
可以用分液漏斗分离的一组混合物是
A. 酒精和碘 B. 苯和水 C. 乙酸和水 D. 溴和四氯化碳
难度: 简单查看答案及解析
-
可逆反应2SO2(g)+O2(g)
 2SO3(g) ΔH<0,在一定条件下达到平衡状态,时间为t1时改变条件
2SO3(g) ΔH<0,在一定条件下达到平衡状态,时间为t1时改变条件 化学反应速率与反应时间的关系如图所示
化学反应速率与反应时间的关系如图所示 下列说法正确的是
下列说法正确的是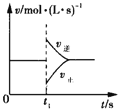
A. 维持温度、容积不变,t1时充入SO3(g) B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar D. 维持温度、压强不变,t1时充入SO3(g)
难度: 中等查看答案及解析
-
干燥剂的干燥性能可用干燥干燥效率(1立方米空气中实际余留水蒸气的质量
 来衡量
来衡量 某些干燥剂的干燥效率如下:
某些干燥剂的干燥效率如下:物质
MgO
CaO
ZnCl2
ZnBr2
干燥效率
0.008
0.2
0.8
1.1
根据以上数据,有关叙述错误的是
A. MgO的干燥性能比CaO差 B. 干燥效率可能与干燥剂的阴阳离子半径大小有关
C. MgCl2可能是比CaCl2更好的干燥剂 D. 上述干燥剂中阳离子对干燥性能的影响比阴离子大
难度: 中等查看答案及解析
-
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是
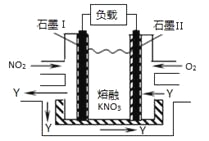
A. O2在石墨Ⅱ附近发生氧化反应
B. 该电池放电时NO3-向石墨Ⅱ电极迁移
C. 石墨Ⅰ附近发生的反应:3NO2 +2e-
 NO+ 2NO3-
NO+ 2NO3-D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
难度: 困难查看答案及解析
-
在含有Fe3+、Fe2+ 、Al3+ 、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数几乎没有变化的是
A. Fe3+ B. Al3+ C. NH4+ D. Fe2+
难度: 中等查看答案及解析
-
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S, 下列有关说法正确的是
A. OCS、CO2、CO、S晶体类型相同 B. OCS高温分解时,碳元素化合价升高
C. OCS中含有1个
 键和1个
键和1个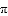 键 D. 22.4LOCS中约含有3×6.02×1023个原子
键 D. 22.4LOCS中约含有3×6.02×1023个原子难度: 困难查看答案及解析
-
下列实验操作与实验目的相符的是
序号
实验操作
实验目的
A
测定HF、HCl熔点、沸点
比较F和Cl的非金属性强弱
B
MgSO4、Al2(SO4)3溶液中分别滴加足量氨水
比较镁、铝的金属性强弱
C
测定等浓度的H2CO3、H2SO3两溶液的pH
比较碳、硫的非金属性强弱
D
向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量
比较氨水和氢氧化铝的碱性强弱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列叙述正确的是
A. 13.8gNO2与足量水反应,转移的电子数为0.2NA
B. 1molOH-与17gNH3所含的电子数分别为9NA和10NA
C. 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得的产物中含有的分子数为0.1NA
D. 1molAlCl3在熔融状态时含有的离子总数为0.4NA
难度: 中等查看答案及解析
-
正在研制的一种“高容量、低成本”锂
 铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
A. 放电一段时间后右侧溶液pH升高
B. 整个反应过程中,铜相当于催化剂
C. 通空气时,铜被腐蚀,表面产生CuO
D. 放电时,正极的电极反应式为Cu2O+H2O+2e-=Cu+2OH-
难度: 中等查看答案及解析
-
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14,混合溶液的pH与盐酸体积(V)的关系如图所示。下列说法正确的是
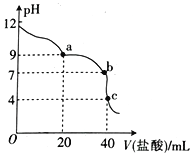
A. Kb(MOH)的数量级为10—11 B. 由c点可算得m=14/3
C. a点: c(Cl-)>c(M+)>(OH-)>c(H+) D. b点溶液呈中性,此时c(Cl-)=c(M+)
难度: 中等查看答案及解析
-
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)
 cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
A. 该温度下此反应的平衡常数的值K=25/4
B. 平衡时,M的转化率为50℅,若条件改为恒温恒压,则达平衡时M的转化率小于50℅
C. 若开始时向容器中充入2molM和1molN,达到平衡时,M的体积分数小于50℅
D. 在5min时,再向体系中充入少量He,重新达到平衡前v(正)>V(逆)
难度: 中等查看答案及解析
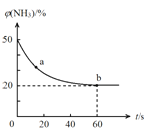
 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。 B(g)+C(g)△H=+85.1kJ⋅mol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
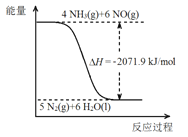
B(g)+C(g)△H=+85.1kJ⋅mol-1,反应时间(t)与容器内气体总压强(p)的数据见下表: 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=_______________。关于该反应的下列说法正确的是______ (填序号)
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=_______________。关于该反应的下列说法正确的是______ (填序号) 。
。
 SO2Cl2(g)△H<0,设计制备磺酰氯SO2Cl2的装置如图:
SO2Cl2(g)△H<0,设计制备磺酰氯SO2Cl2的装置如图: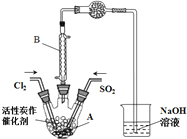
 用含a、NA的代数式表示)g•cm-3。
用含a、NA的代数式表示)g•cm-3。