-
王安石的《元日》:“爆竹声中一岁除,春风送暖入屠苏。千门万户曈曈日,总把新桃换旧符”。诗中涉及了许多化学知识。下列说法正确的是
A.“爆竹声中一岁除”中的爆竹爆炸时发生了复分解反应
B.“春风送暖入屠苏”中,屠苏酒中只含有乙醇和水
C.“千门万户曈曈日”中的能量转化方式包括将太阳能转化为热能
D.“总把新桃换旧符”中的桃符主要成分为纤维素,纤维素和淀粉互为同分异构体
难度: 简单查看答案及解析
-
科研人员发现瑞德西韦对2019-nCoV有抑制作用。有机物M(
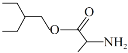 )是合成瑞德西韦的原料之一。下列关于有机物M的描述错误的是
)是合成瑞德西韦的原料之一。下列关于有机物M的描述错误的是A.分子中含有3种官能团 B.能发生水解反应,生成氨基酸和一元醇
C.碳原子上的一氯代物有6种 D.分子中所有碳原子不可能在同一平面
难度: 简单查看答案及解析
-
我国科研工作者构建了一种在反应过程中能同时活化水和甲醇的双功能结构催化剂,用以解决氢气的高效存储和安全运输。下图是甲醇脱氢转化的反应历程(TS表示过渡态)。
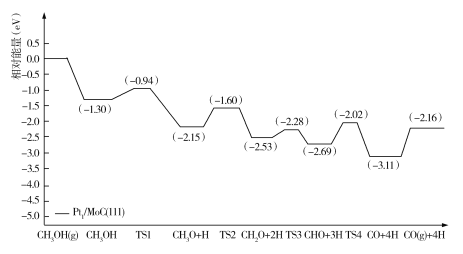
下列说法错误的是
A.CH3OH的脱氢反应是分步进行的
B.甲醇脱氢反应历程的最大能垒(活化能)是1.30 eV
C.甲醇脱氢反应中断裂的化学键有C—H键和O—H键
D.该催化剂的研发为醇类重整产氢的工业应用提供了思路
难度: 中等查看答案及解析
-
利用下列实验装置完成对应的实验,能达到实验目的的是
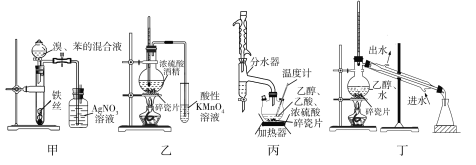
A.装置甲验证苯与液溴发生取代反应 B.装置乙探究酒精脱水生成乙烯
C.装置丙制备乙酸乙酯并提高产率 D.装置丁分离乙醇和水
难度: 中等查看答案及解析
-
某化合物的结构为
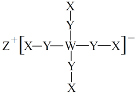 ,其中X、Y、Z、W四种元素分布在三个短周期,原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述正确的是
,其中X、Y、Z、W四种元素分布在三个短周期,原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述正确的是A.简单离子半径:W>Z>Y B.Z的氯化物可促进水的电离
C.最高价氧化物对应水化物的碱性:Z<W D.ZX和Z2Y所含化学键类型完全相同
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖授予了三位研究锂电池的科学家,以表彰他们在锂离子电池发展方面所做出的突出贡献。磷酸铁锂电池是锂离子电池的一种,常用石墨包裹上铜箔作负极,LiPF6的有机溶液作电解质。该电池的总反应方程式为Li1−xFePO4+LixC6
 LiFePO4+C6。下列说法错误的是
LiFePO4+C6。下列说法错误的是A.放电时,负极反应式为LixC6−xe−=xLi++C6
B.充电时,阳极反应式为LiFePO4−xe−=Li1−xFePO4+xLi+
C.若用该电池精炼铜,阴极增重12.8 g,则电池中移向正极的Li+为0.2 mol
D.磷酸铁锂(LiFePO4)是电池的电极材料之一,其中铁的化合价为+2
难度: 中等查看答案及解析
-
常温下,向10 mL 0.1 mol·L−1一元弱酸HA中缓慢滴加0.1 mol·L−1 NaOH溶液,溶液温度与滴加NaOH溶液体积的关系如图所示。下列说法正确的是
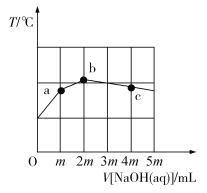
A.m=10
B.a点:2c(Na+)=c(A−)
C.b点:水的电离程度比纯水中的小
D.c点:c(OH−)−c(H+)=2c(HA)+c(A−)
难度: 困难查看答案及解析
 CH2=CH2↑+H2O
CH2=CH2↑+H2O CH2ClCH2Cl(l) ΔH<0
CH2ClCH2Cl(l) ΔH<0 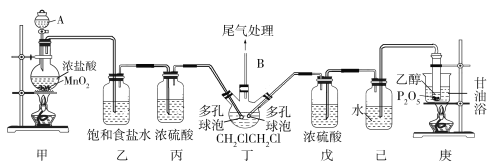
 CH2OHCH2OH+ 2NaCl。所得溶液先用稀硝酸中和至酸性,然后加入1.000 mol·L−1的AgNO3标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35 g白色固体,则产品中1,2−二氯乙烷的纯度为______%。
CH2OHCH2OH+ 2NaCl。所得溶液先用稀硝酸中和至酸性,然后加入1.000 mol·L−1的AgNO3标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35 g白色固体,则产品中1,2−二氯乙烷的纯度为______%。
 )约为5.0×10−3 mol·L−1;溶液中离子的浓度小于1×10−5 mol·L−1时,认为该离子已不存在]。
)约为5.0×10−3 mol·L−1;溶液中离子的浓度小于1×10−5 mol·L−1时,认为该离子已不存在]。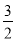 O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式_____。
O2(g)=CO2(g)+2H2O(g) ΔH=−766.6kJ·mol−1,H2O(g)=H2O(l) ΔH=−44kJ·mol−1。请写出表示甲醇燃烧热的热化学方程式_____。 2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为__________。
2N2(g)+3H2O(l)ΔH<0,该反应的平衡常数表达式为__________。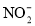 )∶c(HNO2)=10∶1,则混合溶液中
)∶c(HNO2)=10∶1,则混合溶液中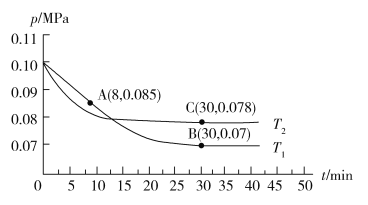
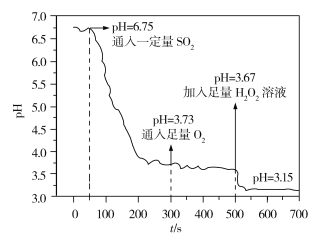
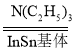 HCOOH。回答下列问题:
HCOOH。回答下列问题:  ”代表锂原子)。
”代表锂原子)。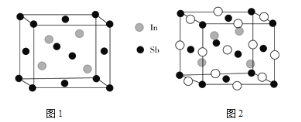
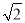 ≈1.4)
≈1.4)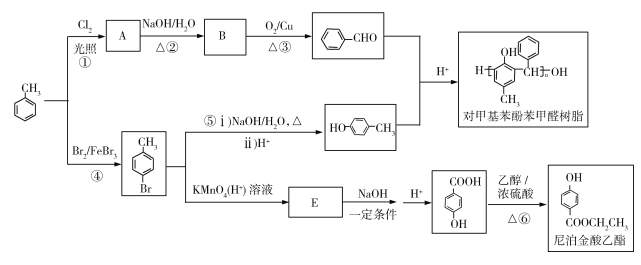
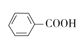
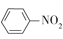
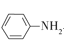
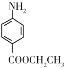 ),设计一种制取苄佐卡因的合成路线(其他反应物自选)_____________。
),设计一种制取苄佐卡因的合成路线(其他反应物自选)_____________。