-
在2020年抗击新型冠状病毒肺炎的战役中化学品发挥了重要作用。下列说法中错误的是( )
A.医用消毒酒精中乙醇的浓度为95%
B.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
C.84消毒液、二氧化氯泡腾片可作为环境消毒剂
D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质
难度: 中等查看答案及解析
-
下列物质分类的正确组合是( )
选项
混合物
纯净物
单质
电解质
A
盐酸
NaOH
石墨
K2SO4溶液
B
空气
Fe(OH)3胶体
铁
Na2CO3
C
CuSO4·5H2O
CaCl2
水银
铜
D
氯水
KNO3晶体
O3
NaCl
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关化学用语不正确的是
A.甲基的电子式:
 B.甲烷分子的球棍模型:
B.甲烷分子的球棍模型: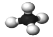
C.中子数为50,质子数为39的钇(Y)的核素:
 D.间—硝基甲苯的结构简式:
D.间—硝基甲苯的结构简式:
难度: 简单查看答案及解析
-
下列物质的名称不正确的是
A.NaHCO3:小苏打 B.BaCO3:重晶石
C.H2NCH2COOH:甘氨酸 D.
 :2-甲基戊烷
:2-甲基戊烷难度: 简单查看答案及解析
-
雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 mol臭氧中含有电子总数为18×6.02×1023
难度: 简单查看答案及解析
-
下列有关金属的工业制法中,正确的是
A.以海水为原料制得精盐,再电解精盐的水溶液制取钠
B.用海水、石灰乳等原料制得氧化镁,再用 H2 还原氧化镁制得镁
C.用焦炭、空气、石灰石等原料,生产 CO 在高温下还原铁矿石制得铁
D.从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语正确的是
A.H2O2的电子式:
 B.NaHCO3的电离:NaHCO3= Na+ + H+ + CO32-
B.NaHCO3的电离:NaHCO3= Na+ + H+ + CO32-C.二氧化硅的分子式:SiO2 D.质子数为8,中子数为10的氧原子:

难度: 中等查看答案及解析
-
化学与社会、生产、生活和科技都密切相关。下列有关说法正确的是
A.“天宫二号”使用的碳纤维,是一种新型有机高分子材料
B.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
C.75%酒精可用于消毒杀死新冠病毒,如果用90%酒精效果更好
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,是一种清洁能源
难度: 简单查看答案及解析
-
下列说法不正确的是
A.HF 比 HCl 稳定性更强,原因是 HF 分子间存在氢键
B.Na 投入到水中,有共价键的断裂与形成
C.CCl4、N2 和 SiO2 晶体中,各原子最外层都达到 8 电子稳定结构
D.NaHSO4 晶体熔融时,离子键被破坏,共价键不受影响
难度: 中等查看答案及解析
-
下列有关有机物的说法正确的是
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.“绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应
C.不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物
D.鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚
难度: 简单查看答案及解析
-
向BaCl2溶液中通入SO2气体,溶液仍然澄清;若将BaCl2溶液分盛在两支试管中,一只试管加稀HNO3,另一只加NaOH溶液,然后再通入SO2气体,结果两支试管都有白色沉淀产生。由此得出的下列结论中不合理的是
A.SO2是酸性氧化物、SO2具有还原性
B.两支试管中的白色沉淀不是同种物质
C.BaCl2既能跟强酸、又能跟强碱反应,具有两性
D.升高pH时,SO2水溶液中SO32-浓度增大
难度: 困难查看答案及解析
-
下列实验中,与现象对应的结论一定正确的是
选项
实验
现象
结论
A.
常温下,将CH4与Cl2在光照下反应后的混合气体通入石蕊溶液
石蕊溶液先变红后褪色
反应后含氯的气体共有2种
B.
向10 mL0.1mol/L NaOH溶液中 先后加入1mL浓度均为0.1mol/L的MgCl2和CuCl2溶液
先生成白色沉淀,后生成蓝色沉淀
Cu(OH)2溶解度小于 Mg(OH)2
C.
加热NH4HCO3固体,在试管口放一小片湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3溶液显碱性
D.
将绿豆大小的金属钠分别加入水和乙醇中
前者剧烈反应
水中羟基氢的活泼性大于乙醇的
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA 代表阿伏加德罗常数的值,下列叙述正确的是
A.88.0 g14CO2与14N2O的混合物中所含中子数为 44 NA
B.1 mol CH3COONa与少量 CH3COOH溶于水所得的中性溶液中,CH3COO-数目为NA
C.17.4 g MnO2与40 mL10 mol/L浓盐酸反应,转移电子的数目为0.2 NA
D.常温下pH=4的醋酸溶液中由水电离出的 H+的数目为 10-10 NA
难度: 中等查看答案及解析
-
下图是从元素周期表中截取的一部分,已知X、Y、Z、W为四种短周期主族元素,下列说法正确的是
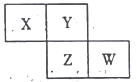
A. 四种元素的原子有可能均能与氢原子形成18电子分子
B. Z元素可能为金属
C. Z的原子半径不一定比Y的原子半径大
D. W的原子序数不可能是X的原子序数的3倍
难度: 中等查看答案及解析
-
已知甲酸的分解反应:HCOOH⇌CO+H2O,△H。在H+催化作用下反应历程为:

根据过渡态理论,其反应过程中的能量变化如图所示,E1、E2、E3均为大于0。
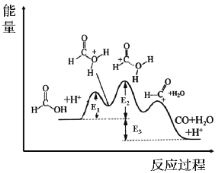
下列说法不正确的是
A.E2为正反应的最高活化能
B.该反应为放热反应,△H=E3
C.图像中第一个峰(过渡态)对应的物质结构为过渡态I
D.使用催化剂后,正逆反应速率同等程度改变,平衡不移动
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱
B.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等
C.稀释1mol・L-1的HCl溶液,溶液中的离子浓度均下降
D.常温下pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO42-)
难度: 中等查看答案及解析
-
我国科学家发明了一种“可固氮”的锂-氮二次电池,将可传递Li+的醚类作电解质,电池的总反应为


 。下列说法正确的是
。下列说法正确的是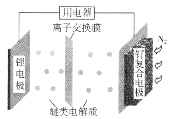
A.固氮时,锂电极发生还原反应
B.脱氮时,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C.固氮时,外电路中电子由钌复合电极流向锂电极
D.脱氮时,Li+向钌复合电极迁移
难度: 困难查看答案及解析
-
己知反应:2A(l)
 B(l)
B(l)  H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
A.a代表20℃下A的Y-t曲线
B.反应到66min时,0℃和20℃下反应放出的热量相等
C.0℃和20℃下达到平衡时,反应都放出QkJ热量
D.反应都达到平衡后,正反应速率a > b
难度: 中等查看答案及解析
-
已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH = - 49.0 kJ•mol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
CH3OH(g)+H2O(g) ΔH = - 49.0 kJ•mol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是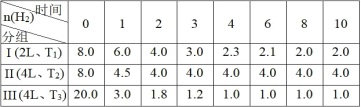
A.在第I组在0~8 min内CO2的平均反应速率为2 mol·L-1·min-1,且放出98 kJ热量
B.第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),则v 正<v 逆
C.3 min时,保持T2,若对第II组加压使体积缩小2 L,重新达平衡后各组分浓度与第I组相同
D.对比第I和第III组,在 0~4 min内,能说明H2的平均反应速率随温度升高而增大
难度: 中等查看答案及解析
-
一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下
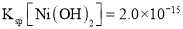 ),工艺流程如下。下列叙述错误的是
),工艺流程如下。下列叙述错误的是
A.废渣的主要成分为二氧化硅
B.黄钠铁矾渣中铁元素为+3价
C.除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D.“沉镍”过程中为了将镍沉淀完全,需调节溶液pH>9
难度: 中等查看答案及解析


 CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l

