-
对中国古代著作中涉及化学的有关说法错误的是( )
A. 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是 Ca(OH)2
B. 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐
C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是 K2CO3
D. 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油
难度: 中等查看答案及解析
-
下列表示正确的是
A. HCl的电子式:
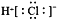 B. 乙炔的结构简式:CHCH
B. 乙炔的结构简式:CHCHC. CS2分子的比例模型:
 D. 质子数为6,中子数为8的核素:
D. 质子数为6,中子数为8的核素: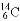
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是 ( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3+ + 4NH3·H2O == AlO2- + 4NH4+ + 2H2O
B. 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O
C. 碳酸钠与次氯酸反应:CO32- + 2HClO = 2ClO- + H2O + CO2↑
D. 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
A. 氯化铁溶液中:Mg2+、K+、Cl-、SCN-
B. 白醋中:K+、N a+、CO32-、SO42-
C. 苏打溶液中:Ca2+、Al3+、Cl-、NO3-
D. 食盐水中:Fe2+、NH4+、Cl-、SO42-
难度: 中等查看答案及解析
-
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
A. 加入少量水,产生H2速率减小,H2体积减小
B. 加入NH4HSO4固体,产生H2速率不变,H2体积不变
C. 加入CH3COONa固体,产生H2速率减小,H2体积不变
D. 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变
难度: 中等查看答案及解析
-
NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应:MnO4-+NO2-+X→Mn2++NO3-+H2O(未配平)。下列叙述中正确的是
A. 生成1mo1NaNO3需消耗0.4mo1KMnO4
B. 反应过程中溶液的pH减小
C. 该反应中NO2﹣被还原
D. X可以是盐酸
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH 和CH3COO—的总数为2NA
B. 1mol P4所含共价键数目为4mol
C. 1 mol K2S与K2S2的混合物中含离子总数为3NA
D. 25 ℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
难度: 中等查看答案及解析
-
化学反应4A(s)+3B(g)⇌2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol/L•min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 2 min末的反应速率用B表示是0.3 mol/(L•min)
D. 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
难度: 中等查看答案及解析
-
已知:①CH3OH(g)+
 O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1②CO(g)+
 O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1③H2(g)+
 O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1④H2(g)+
 O2(g)===H2O(l) ΔH4=-d kJ·mol-1
O2(g)===H2O(l) ΔH4=-d kJ·mol-1
下列叙述正确的是( )A. 由上述热化学方程式可知ΔH3>ΔH4
B. H2的燃烧热为c kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为
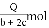 mol
mol难度: 中等查看答案及解析
-
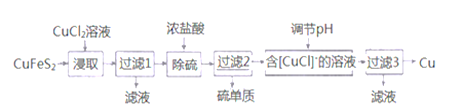
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
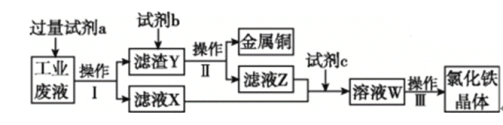
则下列说法正确的是( )
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为2Fe2++Cl2
 2Fe3++2Cl-
2Fe3++2Cl-D. 用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
难度: 中等查看答案及解析
-
如表所示有关物质检验的实验结论正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色
该溶液一定含有SO32-
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊
说明酸性:H2SO3>H2CO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某有机物(如图)是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是
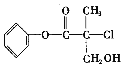
A. 该有机物属于芳香烃
B. 该有机物可以和Br2的CCl4溶液发生加成反应
C. 该有机物和浓硫酸混合加热,可能发生消去反应
D. 1mol该有机物和足量的NaOH溶液反应,最多可与3mol NaOH反应
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)是一种新型高效多功能净水剂,电解浓NaOH溶液制备高铁酸钠的装置如图①所示。下列说法不正确的是( )
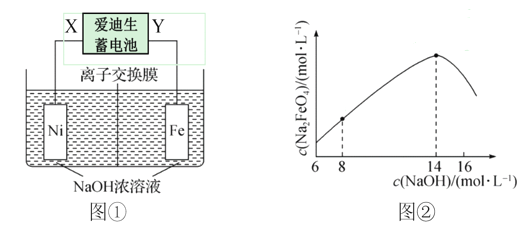
A. X为电源负极,铁电极发生的电极反应式是:Fe - 6e- + 8OH- = FeO42- + 4H2O
B. 离子交换膜为阳离子交换膜
C. 当生成1.66 gNa2FeO4时,收集到的气体在标准状况下的体积是672 mL
D. NaOH溶液的初始浓度与电解后生成的Na2FeO4浓度的变化关系如图②所示,c(Na2FeO4)降低的原因可能是发生了副反应
难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期元素,有关数据如下表,下列叙述正确的是( )
元素代号
X
Y
Z
W
原子半径/pm
66
70
143
160
主要化合价
-2
+5、+3、-3
+3
+2
A. W和Y形成的化合物为共价化合物
B. Y的最高价氧化物对应的水化物为强酸
C. Y的简单气态氢化物的沸点高于X的简单气态氢化物
D. 工业上经常采用电解Z的氯化物溶液制备Z单质
难度: 中等查看答案及解析