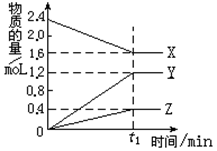
-
下列实验操作中正确的是 ( )
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
难度: 简单查看答案及解析
-
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3;
②单质在反应中都只能作氧化剂;
③对应的含氧酸都是强酸;
④氢化物常温下都是气态,所以又叫气态氢化物;
⑤气态氧化物与水反应都不会再生成气体
A.全部 B.只有①② C.只有①②③④ D.只有①②④⑤
难度: 简单查看答案及解析
-
若以w1和w2分别表示物质的量浓度为c1 mol·L-1和c2 mol·L-1硫酸溶液的质量分数,已知2 w1=w2,则下列推断正确的(硫酸的密度比纯水的大) ( )
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
难度: 简单查看答案及解析
-
下列各物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )
A.甲烷 B.苯 C.乙烯 D.甲苯
难度: 简单查看答案及解析
-
已知氧化还原反应发生的条件是:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。又已知还原性强弱顺序是I->Br—>Fe2+>Cl-(氧化性Cl2>Fe3+>Br2>I2),下列反应的化学方程式或叙述不成立的是 ( )
A.Br2+2HI = I2+2HBr
B.2FeCl2+Cl2=2FeCl3
C.2FeCl2+2HCl+I2=2FeCl3+2HI
D.Cl2通入到NaBr和NaI的混合溶液中:Cl2优先氧化I-
难度: 简单查看答案及解析
-
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是 ( )
A.碳原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的稳定性发生了改变 D.微粒中的键角发生了改变
难度: 简单查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是 ( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+ m,则X的最高正价一定为+ m
难度: 简单查看答案及解析
-
已知A2-核内有x个中子,A原子的质量数为m,则n g A2-所含电子的总物质的量是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下表中对离子方程式的评价不合理的是( )
选项
化学反应及其离子方程式
评价
A.
向氯化铝溶液中加入过量氢氧化钠溶液:
Al3+ + 4OH- = AlO2- + 2H2O
正确
B.
向碳酸钙上滴加稀盐酸:
2H+ + CO32- = CO2↑+ H2O
错误,碳酸钙不应该写成CO32- 形式
C.
向硫酸铵溶液中加入氢氧化钡溶液:
Ba2+ + SO42- == BaSO4↓
正确
D.
铁粉与稀硫酸反应:
2Fe+ 6H+ == 2Fe3+ + 3H2↑
错误, H+的氧化性较弱,只能将铁单质氧化为Fe2+
难度: 简单查看答案及解析
-
某溶液中含有HCO3-、Na+、Ba2+、NO3-等4种离子,若向其中加入少量的Na2O2固体后溶液中离子浓度基本保持不变的是( )
A.HCO3- B.Na+ C.Ba2+ D.NO3-
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 LHF中含有的HF分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
B. 小苏打与氢氧化钠溶液混合:HCO3—+OH—==CO2↑+H2O
C. 氯化钙与碳酸氢钾溶液混合:Ca2++CO32—==CaCO3↓
D. CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42—+2OH—+Ba2+==BaSO4↓+Cu(OH)2↓
难度: 简单查看答案及解析
-
已知1 mol氢气完全燃烧生成水蒸气时放出热量242kJ.且氧气中1 mol O==O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中l mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
共价键、离子键和范德瓦尔斯力都是微粒之间的不同作用力,下列含有上述两种结合力的是 ( )
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B.原子核外电子排布为1s1的原子与原子核外电子排布为1s22s1的原子的化学性质相似
C.所有的非金属元素都分布在p区
D.手性催化剂只催化或者主要催化一种手性分子的合成
难度: 简单查看答案及解析
-
下列推论正确的是 ( )
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
D.NH4+ 为正四面体结构,可推测 PH4+ 也为正四面体结构
难度: 简单查看答案及解析
-
在下列反应中气体反应物只能作还原剂的是 ( )
A.CO2气体通入石灰水:CO2+Ca(OH)2===CaCO3↓+H2O
B.SO2气体通入氢硫酸溶液:SO2+2H2S===3S↓+2H2O
C.CO气体通入盛有灼燃CuO的试管中:
D.将氨气通入硝酸中:NH3+HNO3===NH4NO3
难度: 简单查看答案及解析
-
只用一种试剂就可以把4种无色稀溶液:乙醇、苯酚、AgNO3溶液、KOH溶液一一区分的是 ( )
A.自来水 B.FeCl3溶液 C.BaCl2溶液 D.稀硫酸
难度: 简单查看答案及解析
-
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e- === 2MnO(OH)+2OH-
F极:Zn+2NH4Cl === Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl === 2MnO(OH)+Zn(NH3)2Cl2
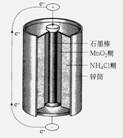
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
难度: 简单查看答案及解析
-
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
难度: 简单查看答案及解析
-
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨,在水浴中加热。实验结果没有银镜产生。其原因是( )
A.蔗糖尚未水解 B.蔗糖水解的产物中没有葡萄糖
C.加热时间不够 D.煮沸后的溶液中没有加碱,以中和作催化剂的酸
难度: 简单查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化( )
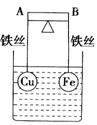
A.杠杆为导体和绝缘体时,均为A端高、B端低
B.杠杆为导体和绝缘体时,均为A端低、B端高
C.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
D.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高
难度: 简单查看答案及解析
-
35.2g FeS与1000 mL 1.3mol/L硝酸溶液恰好完全反应,反应后氧化产物为Fe2(SO4)3和Fe(NO3)3,则硝酸的还原产物为 ( )
A.N2 B.N2O C.NO D.NO2
难度: 简单查看答案及解析