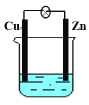
-
下列变化中,属于吸热反应的是
①液氨气化 ②将胆矾加热变为白色粉末 ③稀释浓硫酸 ④氨催化氧化生成NO ⑤氯酸钾分解制O2 ⑥酸碱中和生成水 ⑦氯化铁溶于水显酸性
A.②⑤⑦ B.①③④ C.①②⑤ D.③④⑥
难度: 简单查看答案及解析
-
在CH3COOH溶液中存在如下平衡:CH3COOH
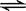 H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是
H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是A.NaCl B.Na2CO3 C.CH3COONa D.NaOH
难度: 中等查看答案及解析
-
氨分解反应在容积为2 L的密闭容器内进行。已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为( )
A.0.32 mol·L-1·s-1 B.0.16 mol·L-1·s-1
C.1.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
难度: 简单查看答案及解析
-
在25℃时,0.01mol·L-1NaOH溶液的pH值是
A.2 B.13 C.12 D.10
难度: 简单查看答案及解析
-
我们仿照pH来定义pOH,即:pOH=-lgc(OH-),则下列溶液一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合所形成的溶液
B.c(H+)=1×10-7mol/L的溶液
C.0.1mol·L-1CH3COONa溶液
D.pH=pOH的溶液
难度: 简单查看答案及解析
-
当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是.( )
A.AgI比AgCl稳定 B.氯的非金属性比碘强
C.I-的还原性比Cl-强 D.AgI的溶解度比AgCl小
难度: 简单查看答案及解析
-
某金属能与盐酸反应放出氢气,该金属与锌组成的原电池中,锌为原电池的负极,则金属可能是
A.铝 B.铜 C.铁 D.镁
难度: 简单查看答案及解析
-
用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
难度: 中等查看答案及解析
-
碳铵(NH4HCO3)在室温下就能自发地分解产生氨气,下列有关说法中正确的是:
A.碳铵分解是因为生成了易挥发的气体,使体系的熵增大 B.碳铵分解是因为外界给予了能量
C.碳铵分解是吸热反应,根据焓判据,不能自发分解 D.碳酸盐都不稳定,都能自发分解
难度: 简单查看答案及解析
-
如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是
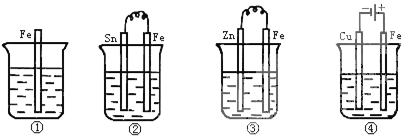
A.④>②>①>③ B.②>①>③>④ C.③>②>④>① D.④>②>③>①
难度: 中等查看答案及解析
-
下列各变化的方程式中,属于正确的水解反应的是
A.
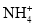 +H2O⇌H3O++NH3↑ B.
+H2O⇌H3O++NH3↑ B.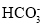 +OH-⇌H2O+
+OH-⇌H2O+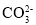
C.CH3COOH+H2O⇌CH3COO-+H3O+ D.
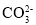 +H2O⇌
+H2O⇌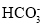 +OH-
+OH-难度: 简单查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1.0×10-11mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、
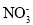 、Cl- B.K+、Na+、Cl-、
、Cl- B.K+、Na+、Cl-、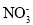
C.K+、Na+、Cl-、
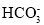 D.K+、
D.K+、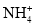 、
、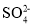 、
、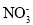
难度: 简单查看答案及解析