-
下列物质在水中溶解性最好的是( )
A.CO2 B.NH3 C.SO2 D.CH4
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
难度: 简单查看答案及解析
-
下列事实与氢键有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.水加热到很高的温度都难以分解
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.水结成冰体积膨胀
难度: 简单查看答案及解析
-
下列叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同( )
A.①③ B.②④ C.②⑤ D.④⑥
难度: 简单查看答案及解析
-
以下各分子中,所有原子都满足最外层为8电子结构的是
A.H3O+ B.BF3 C.CCl4 D.PCl5
难度: 简单查看答案及解析
-
关于原子轨道的说法正确的是( )
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ/mol。据下表所列数据判断错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
某元素原子3p能级上有一个空轨道,则该元素为( )
A. Na B. Si
C. Al D. Mg
难度: 简单查看答案及解析
-
下列表达方式错误的是
A.四氯化碳的电子式:
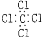 B.氟化钠的电子式:
B.氟化钠的电子式: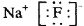
C.硫离子的核外电子排布式:1s22s22p63s23p6 D.碳-12原子:
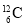
难度: 简单查看答案及解析
-
下列性质中,可以证明某化合物中一定存在离子键的是
A.可溶于水 B.有较高的熔点
C.水溶液能导电 D.熔融状态能导电
难度: 简单查看答案及解析
-
下面的价电子排布中,第一电离能最小的原子可能是( )
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.冰熔化时,分子中 H—O 键发生断裂
B.金属晶体的熔、沸点一定比分子晶体的高
C.原子晶体中,共价键的键长越短,键能越大,熔点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
难度: 简单查看答案及解析
-
共价键、离子键和范德华力都是微粒之间的不同作用力,下列含有上述两种结合力的是
①Na2O2②SiO2③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.乙烯中
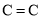 的键能是乙烷中
的键能是乙烷中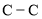 的键能的2倍
的键能的2倍B.氮气分子中含有1个
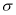 键和2个π键
键和2个π键C.
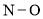 键的极性比
键的极性比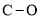 键的极性大
键的极性大D.
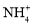 中4个
中4个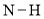 键的键能不相同
键的键能不相同难度: 中等查看答案及解析
-
下列关于丙烯(CH3-CH=CH2)的说法正确的 ( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子中只存在极性键
D.丙烯分子中3个碳原子在同一直线上
难度: 中等查看答案及解析
-
原子序数小于 18 的元素 X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是
A.
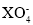 B.
B.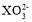 C.
C.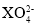 D.
D.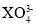
难度: 简单查看答案及解析
-
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,下图是已经合成的最著名的硫-氮化合物的分子结构。下列关于该物质说法正确的是
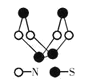
A. 分子式为SN
B. 分子中所有共价键的键长一定相等
C. 该物质与化合物S2N2互为同素异形体
D. 分子中既有极性键又有非极性键
难度: 中等查看答案及解析
-
下列叙述正确的是
A.在周期表中零族元素的单质全部是气体
B.同周期元素的原子半径为ⅦA族的为最大
C.第ⅠA、ⅡA 族元素的原子,其半径越大,第一电离能越大
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
难度: 简单查看答案及解析
-
某主族元素的原子最外层电子排布是 5s1,该元素或其化合物不可能具有的性质是
A.该元素的氧化物的水合物显碱性 B.其原子半径比钾原子半径大
C.其碳酸盐易溶于水 D.该元素单质常温下跟水反应不如钠剧烈
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式:
①
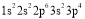 ;②
;② 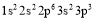 ;③
;③ 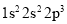 ;④
;④ 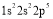 。
。则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4﹤CCl4﹤CBr4﹤CI4 B.硬度由大到小:金刚石>碳化硅>晶体硅
C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 D.晶格能由大到小: NaI>NaBr> NaCl>NaF
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.只有活泼金属与活泼非金属之间才能形成离子键 B.具有共价键的化合物是共价化合物
C.具有离子键的化合物是离子化合物 D.化学键是分子中多个原子之间强烈的相互作用
难度: 简单查看答案及解析
-
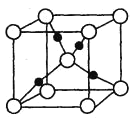
有关晶体的结构如图所示,下列说法中不正确的是( )
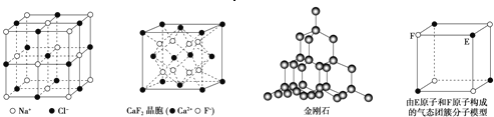
A.在NaCl 晶体中,距Na 最近的Cl 形成正八面体
B.在
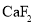 晶体中,每个晶胞平均占有4 个Ca2+
晶体中,每个晶胞平均占有4 个Ca2+C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为EF或FE
难度: 中等查看答案及解析
-
铍的性质类似于铝,下列有关铍性质和结构的推断正确的是
A.铍与铝原子核外具有相同的未成对电子数
B.氢氧化铍能与强酸、强碱溶液反应
C.铍与铝元素具有相同的最高正化合价
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
难度: 简单查看答案及解析
-
周期元素 X、Y、Z、W 在元素周期表中的相对位置如图所示。其中 Y 所处的周期序数与族序数相等。下列说法正确的是
X
Y
Z
W
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.W 的最高价氧化物与水反应形成的化合物是离子化合物
D.X 的气态氢化物的水溶液能与 Y 的最高价氧化物对应水化物发生反应
难度: 简单查看答案及解析
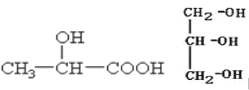
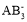 中,A原子轨道的杂化类型是_____________,与
中,A原子轨道的杂化类型是_____________,与  g‧cm-3,阿伏加德罗常数为NA,则晶胞边长为_______________cm(用含 、NA 的式子表示)。
g‧cm-3,阿伏加德罗常数为NA,则晶胞边长为_______________cm(用含 、NA 的式子表示)。