-
在新冠疫情防控中,化学知识、化学原理等起到了至关重要的作用。下列说法不正确的是
A.“84”消毒液(主要含 NaClO)需在避光条件下密封保存
B.N95 型口罩的核心材料聚丙烯属于新型无机高分子材料
C.医用酒精消毒的原理是使病毒和细菌的蛋白质变性
D.传播新冠病毒的“飞沫”与空气形成的分散系是气溶胶
难度: 简单查看答案及解析
-
下列表示反应 NaHSO4+NaHCO3=Na2SO4 + H2O十CO2↑中相关微粒的化学用语不正确的是
A.CO2的结构式: O=C= O
B.H2O的电子式:
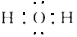
C.Na+的结构示意图:
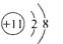
D.水溶液中,NaHCO3的电离方程式: NaHCO3=Na+ + H+ + CO

难度: 简单查看答案及解析
-
下表列出的有关物质的性质与用途具有对应关系的是
选项
物质的性质
用途
A
MgO难溶于水
耐火材料
B
SO2具有强的还原性
漂白纸张
C
CuSO4易溶于水
游冰池杀菌消毒
D
NaHCO3能与酸反应
治疗胃酸过多
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
室温下 ,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol • L-1的盐酸:Na+、Cu2+、SO
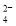 、NO
、NO
B.0. 1 mol • L-1的氨水:K+、Al3+、Cl‑、CH3COO-
C.0. 1 mol • L-1的Fe(NO3)3溶液: H+、K+、Cl-、I-
D.0.1 mol• L -1的Na2SO3溶液:NH
 、Na+、ClO-、SO
、Na+、ClO-、SO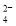
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.0. 1 mol • L-1的CaCl2 溶液中Ca2+的数目为0. lNA
B.标准状况 下,11. 2 L CHCl3 所含的分子数目为0. 5 NA
C.2. 8 g 乙烯含有的共用电子对的数目为 0. 6 NA
D.常温下,1 molFe与足量浓H2SO4反应,转移电子数为0.3NA
难度: 简单查看答案及解析
-
2019 年诺贝尔化学奖授予英国科学家古德纳夫及另外两位科学家,以表彰他们在锂离子电池研究中的杰出贡献。 LiFePO4是用于制备大功率锂离子电池的正极材料 ,且一种制备流程如下:
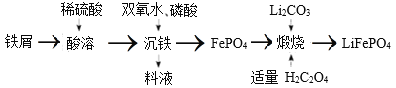
下列有关说法不正确的是
A.LiFePO4中Fe的化合价为+2
B.“沉铁”过程中双氧水作氧化剂
C.料液可循环利用
D.“煅烧”中有大量的CO2 、CO生成
难度: 中等查看答案及解析
-
历史上曾利用“地康法”制氯气,其原理是以氯化铜作催化剂,利用氧气氧化氯化氢。如图为“地康法”制氯气的模拟装置.下列关有说法不正确的是

A.关闭 K2打开K1, 若漏斗中的液面不持续下降 ,则装置1的气密性良好
B.打开K3 ,将浓盐酸逐滴滴入浓硫酸中可制备反应所需要的氯化氢
C.装置 2 中盛放的是浓硫酸,通过观察气泡逸出的快慢可判断气体的通入量
D.后续需要净化氯气的装置中 ,除杂试剂依次为饱和食盐水、碱石灰
难度: 中等查看答案及解析
-
已知工业上常用“有效氢含量”衡量含氢还原剂的还原能力,其定义为 :每克含氢还原剂的还原能力相当于多少克H2的还原能力。硼氢化钠(NaBH4)是一种极强的含氢还原剂,下列有关说法正确的是
A.NaBH4作还原剂时 ,其中的硼元素被氧化
B.NaBH4 的“有效氢含量”约为0.21
C.反应8Au3+ +BH
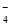 +OH-→ 8Au+BO
+OH-→ 8Au+BO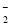 +H2O中水的化学计量数为16
+H2O中水的化学计量数为16D.NaBH4遇水产生大量的氧气可作供氧剂
难度: 困难查看答案及解析
-
如图是从小白菊中提取的一种有机物。下列关于该有机物的说法正确的是
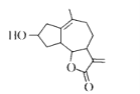
A.可在酸件或碱性溶液中稳定存在
B.其同分异构体存在芳香族化合物
C.能使溴水或酸性KMnO4溶液褪色,其原理相同
D.分子中所有原子一定在同一平面内
难度: 中等查看答案及解析
-
NO在催化剂表面催化分解反应历程如图所示(TS表示反应中的过渡态)。下列有关说法中正确的是

A.分解反应的热化学方程式为 2NO(g)
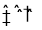 N2(g)+O2(g)△H = +43.77 kcal• mol-1
N2(g)+O2(g)△H = +43.77 kcal• mol-1B.中间产物3中的键能大于中间产物4的,中间产物3更稳定
C.历程中“5→TS4→6”的活化能最大,该历程决定整个反应的快慢
D.使用高效催化剂,降低NO的相对能量,从而影响反应热的大小
难度: 中等查看答案及解析
-
X、Y、Z、W 为短周期主族元素,其常见化合价与原子半径的关系如图所示。已知四种元素中只有 Y 与 Z 同周期,下列说法正确的是( )
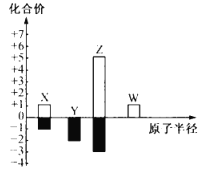
A.简单氢化物的稳定性:Y<Z
B.X、Y、Z 可组成盐类化合物
C.X 的氧化物中不可能含非极性键
D.W 的最高价氧化物对应水化物为弱碱
难度: 中等查看答案及解析
-
电解法制备磷酸二氢钾(KH2PO4)装置如图所示。下列说法正确的是

A.与 a 相连接的电源电势比 b 的高
B.离子交换膜 x、y 分别为阳离 子、阴离子交换膜
C.电解时,理论上相同时间内通过交换膜的阴、阳离子数相等
D.当外电路中通过 1mol 电子时,会有ll.2L的Cl2生成
难度: 中等查看答案及解析
-
通过下列实验操作和实验现象,得出的结论正确的是
选项
实验操作和现象
结论
A
常温下,分别测定浓度均为0.1mol• L-1的Na2CO3溶液与CH3COONa溶液的 pH,Na2CO3溶液的pH大于CH3COONa溶液
HCO3电离出H+的能力比CH3COOH的弱
B
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
C
将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,有白色沉淀产生
样品接触空气己氧化变质
D
取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝
淀粉已经完全水解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25°C, 在 0. 1 mol• L-1 的CH3COOH 溶液中滴加 NaOH溶液,溶液中c(CH3COOH)、c(CH3COO-)与 pH的关系如图所示。下列叙述正确的是

A.曲线I表示混合溶液中c(CH3COO-)随pH变化关系
B.a点溶液的导电能力比b点的强
C.25℃时,CH3COOH的电离平衡常数为10-4.75
D.pH=5.5的溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)
难度: 中等查看答案及解析



 [CuCl3]2-(色无溶液)。
[CuCl3]2-(色无溶液)。



 为主要原料制备
为主要原料制备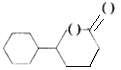 的合成路线: ___(其他无机试剂任选)。
的合成路线: ___(其他无机试剂任选)。