-
随着人们对物质组成和性质研究的深入,物质的分类更加多样化。下列有关说法正确的是( )
A. Na2O2、Al2O3、Fe2O3都是碱性氧化物 B. 磁铁矿、盐酸、绿矾都是混合物
C. CH3COOH、NH3·H2O、HClO都是弱电解质 D. 烧碱、纯碱、熟石灰都是碱
难度: 简单查看答案及解析
-
下列关于电解质、非电解质的说法正确的是
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质
C.导电能力弱的溶液肯定是弱电解质的溶液
D.HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质
难度: 中等查看答案及解析
-
常温下,发生下列反应:
①16H++10Z﹣+2XO4﹣=2X2++5Z2+8H2O
②2A2++B2=2A3++2B﹣
③2B﹣+Z2=B2+2Z﹣根据上述反应,下列结论判断错误的是( )
A.A3+是A2+的氧化产物
B.氧化性强弱的顺序为XO4﹣>B2
C.反应Z2+2A2+=2A3++2Z﹣在溶液中可发生
D.Z2在①③反应中均为还原剂
难度: 中等查看答案及解析
-
下列除杂质的操作方法正确的是( )
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的CO:通过灼热的氧化铜
D.NO2中有少量NH3:用水洗涤后干燥
难度: 中等查看答案及解析
-
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
反应物
a+b
a+c
b+c
c+d
b+d
现象
白色沉淀
白色沉淀
白色沉淀
白色沉淀
无色气体
由上述现象可推知a、b、c、d依次是
A. HCl、BaCl2、AgNO3、Na2CO3 B. AgNO3、HCl、Na2CO3、BaCl2
C. BaCl2、Na2CO3、AgNO3、HCl D. AgNO3、HCl、BaCl2、Na2CO3
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法不正确的是
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5µm的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
难度: 中等查看答案及解析
-
化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2,推测2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。下列各组类比中正确的是
A.钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.铝和硫直接化合能得到Al2S3, 推测:铁和硫直接化合也能得到 Fe2S3
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2CO3+2HCl =2NaCl +H2O+ CO2↑
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.将78Na2O2与过量H2O反应转移的电子数为NA
B.2mol SO2与 1mol O2反应生成的SO3 分子数为2NA
C.标准状况下,2.24L SO3中所含原子数为0.4NA
D.1molCl2参加反应转移电子数一定为2NA
难度: 中等查看答案及解析
-
下列两种物质相互作用,反应条件或者反应物用量改变,不会引起产物种类改变的是( )
A.Na和O2 B.NaOH和CO2 C.Fe和Cl2 D.HCl和Na2CO3
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是 ( )
A.K+、Na+、S2-、MnO4- B.Na+、NH4+、SO42-、Cl-
C.Fe3+、Mg2+、NO3-、SCN- D.NO3-、H+、Fe2+、Cl-
难度: 中等查看答案及解析
-
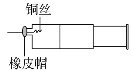
实验是化学研究的基础。关于下列各实验装置图的叙述中正确的是( )
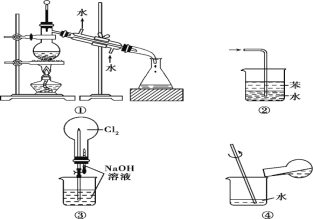
A. 装置①常用于分离互不相溶的液态混合物
B. 装置②可用于吸收氨气,且能防止倒吸
C. 用装置③不可以完成“喷泉”实验
D. 用装置④稀释浓硫酸和铜反应冷却后的混合液
难度: 中等查看答案及解析
-
1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A.S在过量的O2中充分燃烧,可得SO3
B.除去NaHCO3固体中混有Na2CO3的的最好办法是加热
C.浓硝酸具有强氧化性,常温下可与铁剧烈反应放出大量的NO2
D.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,消耗HCl的物质的量之比为2∶1
难度: 中等查看答案及解析
-
下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴入酚酞的烧碱溶液 ⑤淀粉—碘溶液
A. ①②③ B. ②③④ C. ③④⑤ D. ②③⑤
难度: 中等查看答案及解析
-
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中正确的是
A.该反应的氧化剂与还原剂物质的量之比为2:1
B.Cu2S 在反应中只做还原剂
C.Cu 是氧化产物,SO2是还原产物
D.每生成38.4gCu,反应中转移0.6mol电子
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀.
B.向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失
C.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
D.分液时,分液漏斗中下层液体从下口流出,上层液体也从下口放出
难度: 中等查看答案及解析
-
将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是
A.5︰3 B.2︰3 C.1︰1 D.2︰1
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.鉴别Na2CO3和NaHCO3溶液:分别加入澄清石灰水,观察是否有白色沉淀产生
B.利用丁达尔效应鉴别FeCl3溶液和FeCl2溶液
C.除去FeCl2溶液中含有的少量FeCl3,可加入足量铜粉,然后过滤
D.镁在空气中燃烧的产物不仅有MgO,还有Mg3N2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
难度: 困难查看答案及解析
-
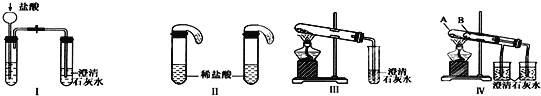
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
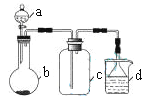
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将3.2 gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2和NO的混合气体共 0.08 mol。则原溶液中HNO3的物质的量为( )
A.0.34 mol B.0.38 mol C.0.28 mol D.0.18 mol
难度: 简单查看答案及解析
-
有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A.K+不一定存在 B.Ba2+、Mg2+不一定都存在
C.Cl-不一定存在 D.混合溶液中CO32-的浓度为0.2 mol/L
难度: 困难查看答案及解析
-
取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色 B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色 D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
难度: 简单查看答案及解析
-
向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
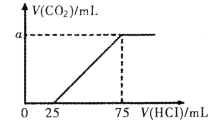
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
难度: 中等查看答案及解析
-
向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
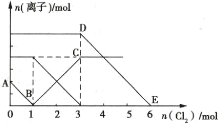
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
难度: 困难查看答案及解析