-
2019年9月25日,北京大兴国际机场正式投入运营。在这一形似“凤凰展翅”的宏伟建筑中,使用了大量种类各异的材料。下列关于所使用材料的分类不正确的是
选项
A
B
C
D
材料

含钒钢筋

安检塑料筐

有机玻璃标牌

玻璃钢内筒垃圾桶
分类
合金材料
高分子材料
无机硅酸盐材料
复合材料
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
厨房中有很多调味品,它们可以补充食品在加工过程中失去的味道、增强原有的味道或添加一些额外的味道。下列说法不正确的是
A.醋能增加食品的酸味,还具有防腐作用
B.人体需控制食盐摄入量,以降低患高血压的风险
C.味精的主要成分是谷氨酸的钠盐,谷氨酸属于氨基酸
D.白砂糖的主要成分是蔗糖,蔗糖属于天然高分子化合物
难度: 中等查看答案及解析
-
下列各组物质均可用酸性KMnO4溶液鉴别的是
A.油酸和硬脂酸 B.苯和环己烷 C.葡萄糖和麦芽糖 D.丁烯醛和丁醛
难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期元素在周期表中的位置关系如右图所示,X原子最外层有5个电子。下列说法正确的是
A.离子半径:W−< Z2− B.还原性:Z2−<W−
C.酸性:H3YO4 >HXO3 D.氢化物的稳定性:YH3> H2Z
难度: 中等查看答案及解析
-
泛酸和乳酸均易溶于水并能参与人体代谢,结构简式如下图所示。下列说法不正确的是
泛酸
 乳酸
乳酸
A.泛酸分子式为C9H17NO5
B.泛酸在酸性条件下的水解产物之一与乳酸互为同系物
C.泛酸易溶于水,与其分子内含有多个羟基易与水分子形成氢键有关
D.乳酸在一定条件下反应,可形成六元环状化合物
难度: 中等查看答案及解析
-
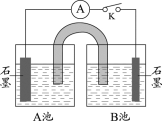
下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是
A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2mol电子,理论上可在b处得到标准状况下1.12L气体
难度: 中等查看答案及解析
-
下列实验中,能达到相应实验目的的是



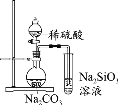
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断S、C、Si的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列用于解释事实的方程式书写不正确的是
A.0.1 mol/L氨水的pH约为11.1:NH3·H2O
NH4+ + OH-
B.用明矾[KAl(SO4)2·12H2O]作净水剂:Al3++ 3H2O
Al(OH)3 (胶体) + 3H+
C.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72-(橙色) + H2O
2CrO42-(黄色) +2H+
D.用饱和Na2CO3溶液处理水垢中的CaSO4:Ca2++ CO32−=CaCO3↓
难度: 中等查看答案及解析
-
某温度下,恒容密闭容器内发生反应:H2(g)+I2 (g)
2HI(g) Δ H< 0,该温度下,K=43。某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01mol/L、0.02mol/L。一段时间后,下列情况与事实相符的是
A.混合气体颜色变深 B.混合气体密度变大
C.氢气的体积分数变小 D.容器内压强变小
难度: 中等查看答案及解析
-
以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
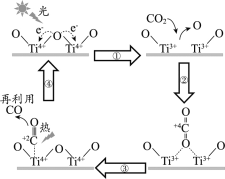
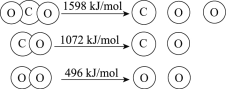
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
难度: 中等查看答案及解析
-
1984年,北京地坛医院成功研制了一种高效杀菌消毒试剂,此试剂后被命名为“84消毒液”。工业上,将氯气通入NaOH溶液可直接制得“84消毒液”。下列说法不正确的是

A.“84消毒液”的有效成分是NaClO
B.“84消毒液”能漂白棉、麻、纸张
C.“84消毒液”与酸性洁厕剂混用会产生Cl2
D.“84消毒液”久置失效,只涉及到氧化还原反应
难度: 中等查看答案及解析
-
向10.00 mL 0.50 mol/L NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
实验
序号
c(CaCl2)(mol·L-1)
滴加CaCl2溶液时的
实验现象
加热浑浊液时的
实验现象
①
0.05
至1.32 mL时产生明显浑浊,但无气泡产生
有较多气泡生成
②
0.005
至15.60 mL时产生明显浑浊,但无气泡产生
有少量气泡生成
③
0.0005
至20 mL未见浑浊
A.①中产生浑浊的原因是c(Ca2+)·c(CO32−)>Ksp(CaCO3)
B.未加热前①和②中发生了反应:2HCO3-+Ca2+=CaCO3↓+H2CO3
C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D.向上述NaHCO3溶液中加入足量0.5 mol/LCaCl2溶液,可能同时产生浑浊和气泡
难度: 中等查看答案及解析
-
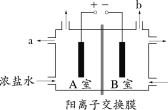
某微生物电池在运行时可同时实现净化有机物污水、净化含Cr2O72-废水(pH约为6)和淡化食盐水,其装置示意图如下图所示。图中,D和E为阳离子交换膜或阴离子交换膜,Z为待淡化食盐水。已知Cr3+完全沉淀所需的pH为5.6。下列说法不正确的是
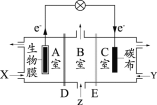
A.E为阴离子交换膜
B.X为有机物污水,Y为含Cr2O72-废水
C.理论上处理1mol的Cr2O72-的同时可脱除6mol的NaCl
D.C室的电极反应式为Cr2O72- + 6e- + 8H+=2Cr(OH)3↓ + H2O
难度: 中等查看答案及解析
-
在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器
温度/K
起始时物质的量/mol
平衡时物质的量/mol
n(CO2)
n(C)
n(CO)
n(CO)
I
977
0.28
0.56
0
0.4
II
977
0.56
0.56
0
x
III
1250
0
0
0.56
y
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%
难度: 中等查看答案及解析