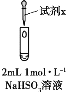
-
化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精

B.铝粉与强碱溶液反应放热

C.植物油在空气中变质,产生“哈喇”味

D.海水经风吹日晒获得粗盐

难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.顺-2-丁烯和反-2-丁烯加氢产物不相同
B.苯酚和甲醛通过聚合反应可制得高分子材料
C.采用多次盐析和溶解,可以分离提纯蛋白质
D.淀粉和纤维素在酸作用下水解的最终产物都是葡萄糖
难度: 中等查看答案及解析
-
下列物质的用途与其体现的性质对应关系不合理的是( )
物质
用途
体现的性质
A
SO2
生产硫酸
还原性
B
NH3
生产碳酸氢铵
还原性
C
SiO2
制取硅单质
氧化性
D
Fe2O3
冶炼金属铁
氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列事实不能用元素周期律解释的是( )
A.碱性:CsOH > KOH B.氢化物稳定性:H2O >H2S
C.金属性:Na >Mg D.热稳定性:Na2CO3 > NaHCO3
难度: 中等查看答案及解析
-
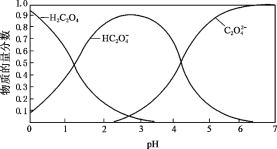
工业制备硝酸的反应之一为:3NO2 + H2O = 2HNO3 + NO。用NA表示阿伏加德罗常数,下列说法正确的是( )
A.室温下,22.4 L NO2 中所含原子总数为3 NA
B.36 g H2O中含有共价键的总数为2NA
C.上述反应,生成1 mol HNO3转移电子的数目为NA
D.标准状况下,11.2 L NO中所含电子总数为5 NA
难度: 中等查看答案及解析
-
下列除杂试剂选择正确且除杂过程涉及氧化还原反应的是( )
物质(括号内为杂质)
除杂试剂
A
Cl2(HCl)
水、浓H2SO4
B
NH4Cl溶液 (FeCl3)
氨水
C
CH2 = CH2(CH3CH2OH)
酸性KMnO4溶液
D
CH3COOCH2CH3(CH3COOH)
饱和Na2CO3溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列解释事实的离子方程式不正确的是( )
A.用石墨电极电解饱和食盐水:2Cl- + 2H2O
2OH-+ H2↑+ Cl2↑
B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO32-
CaCO3(s) + SO42-
C.过量铁粉与稀硝酸反应:Fe+NO3-+4H+= Fe3++NO↑+2H2O
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列实验不能达到实验目的的是( )
A.
 实验室制取氨气
实验室制取氨气B.
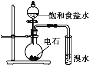 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色C.
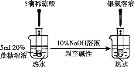 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性D.
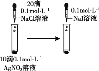 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI难度: 中等查看答案及解析
-
据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:
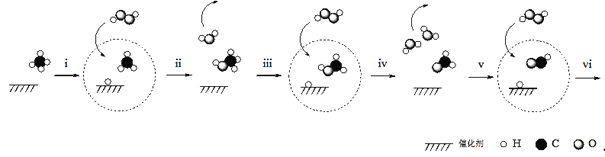
下列说法不正确的是( )
A.图中
代表H2O2
B.步骤i、ii的总反应方程式是
C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
难度: 中等查看答案及解析
-
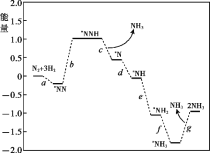
通过以下反应均可获取H2。
① C(s) + H2O (g) =CO(g)+H2(g) ΔH1 = + 131.3 kJ·mol-1
② CH4 (g)+H2O(g) = CO(g)+3H2 (g) ΔH2 = + 206.1 kJ·mol-1
③ CO(g)+H2O(g) = CO2(g)+H2(g) ΔH3
下列说法正确的是( )
A.①中反应物的总能量大于生成物的总能量
B.②中使用适当催化剂,可以使ΔH2减小
C.由①、②计算反应CH4 (g) = C (s) + 2H2 (g) 的ΔH =-74.8 kJ·mol-1
D.若知反应C (s) + CO2 (g) = 2CO (g) 的ΔH,结合ΔH1可计算出ΔH3
难度: 中等查看答案及解析
-
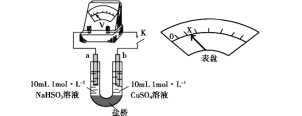
研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。

下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
难度: 中等查看答案及解析
-
一定条件下,有机化合物 Y 可发生重排反应:

下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.1 mol Y最多能与2 mol NaOH发生反应
D.通过调控温度可以得到不同的目标产物
难度: 中等查看答案及解析
-
人造海绵的主要成分是聚氨酯,合成方法如下:

下列说法不正确的是( )
A.M的分子式为C15H10N2O2
B.合成聚氨酯的反应属于缩聚反应
C.聚氨酯在一定条件下可发生水解反应
D.聚氨酯和蛋白质分子中均含有
结构
难度: 中等查看答案及解析
-
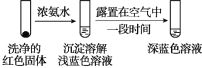
研究苯酚与FeCl3溶液的显色反应,实验如下:
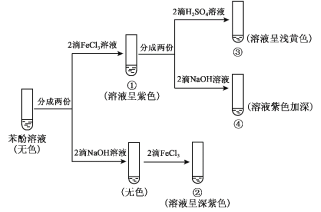
下列说法不正确的是( )
A.苯酚的电离方程式是
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(
)相关
难度: 中等查看答案及解析
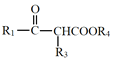 +R2OH
+R2OH