-
乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L−1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
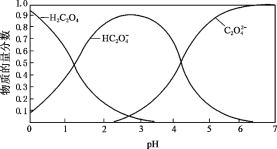
① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是_______。
② 0.1 mol·L−1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。
a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–)
b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2+ + H2C2O4 + xH2O ⇌ FeC2O4·xH2O↓ + 2H+
① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_____。
② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。
-
乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1 mol· L-1 H2C2O4的pH=1.3 ;0.1 mol· L-1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
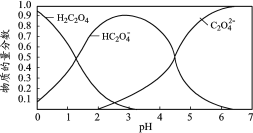
A.pH=4.5的草酸溶液中含有的大量微粒有:H2C2O4、HC2O4-、C2O42-
B.0.1 mol·L−1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑ +8H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:2HC2O4- +Ca2++2OH-=Ca C2O4↓ +2H2O+C2O42-
-
乙二酸( )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得 溶液的
溶液的 ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:
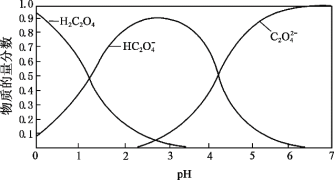
i.向草酸溶液中滴加 溶液至
溶液至 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入 ,调节
,调节 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:
该反应的平衡常数表达式 _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:
i.一定条件下,测得上述反应中溶液中 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以 浓度的变化表示此反应
浓度的变化表示此反应 内的平均反应速率为____________
内的平均反应速率为____________
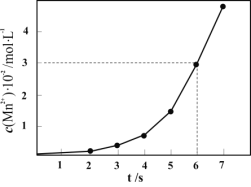
ii.分析 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取 的高锰酸钾产品,配成
的高锰酸钾产品,配成 溶液,取出
溶液,取出 ,消耗
,消耗 草酸标准溶液
草酸标准溶液 ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
-
乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示。)填空:
| H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式________________。
(2)KHC2O4溶液显酸性的原因是_________________;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式____________________;又知该反应开始时速率较慢,随后大大加快,可能的原因是______________________。
-
PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O )=c(HC2O
)=c(HC2O )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O )>c(C2O
)>c(C2O )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
-
PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O )=c(HC2O
)=c(HC2O )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O )>c(C2O
)>c(C2O )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
-
“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L−1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×10−9]
A.若将溶液不断加水稀释,则水的电离程度增大
B.溶液中各离子浓度大小关系:c(Na+)> c(C2O42−)> c(OH−)> c(H+)> c(HC2O4−)
C.若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10−5
D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10−8 mol·L−1 时即能产生沉淀
-
“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L-1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×10-9]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42-)> c(OH-)> c(H+)> c(HC2O4-)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10-5
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8 mol·L-1 时即能产生沉淀
-
“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L-1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×10-9]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42-)> c(OH-)> c(H+)> c(HC2O4-)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10-5
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8 mol·L-1 时即能产生沉淀
-
乙二酸俗称草酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
| H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
填空:
(1)写出H2C2O4的电离方程式_______.
(2)KHC2O4溶液显酸性的原因是_____;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.c(K+)=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
b.c(Na+)=c(H2C2O4)+c(C2O42﹣)
c.c(K+)+c(Na+)=c(HC2O4﹣)+c(C2O42﹣)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是_______.
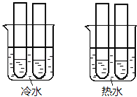
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________,但该实验始终没有看到溶液褪色,推测原因_______.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式________.